近年来的研究揭示代谢调控免疫细胞的发育、分化和功能。例如,微生物刺激巨噬细胞后,细胞内葡萄糖代谢信号通路被激活,提供能量和生物大分子,让细胞合成并分泌效应细胞因子以抵抗炎症。Tucey等报道维持葡萄糖稳态是抗真菌感染的关键环节。代谢和免疫如何整合以维持机体的健康状态?
Sirtuins是一类高度保守、 NAD + 依赖的去乙酰化酶家族蛋白,哺乳动物中一共有7个成员(SIRT1-7)。Sirtuins可以对多种底物进行去酰基化修饰,在机体内参与寿命延长、能量代谢,维持细胞抗胁迫能力。SIRT1和SIRT6通过调控T细胞葡萄糖代谢,影响炎症和炎癌转化的研究结果提示我们,靶向Sirtuins调控免疫细胞代谢是一种潜在的重要抗炎策略。
2020年5月15日,复旦大学杨芃原、余红秀团队在Protein & Cell上发表了题为SIRT5 is important for bacterial infection by regulating insulin secretion and glucose homeostasis的研究论文。该研究揭示了SIRT5在感染性炎症中的重要功能,在Sirt5基因敲除的小鼠中巨噬细胞和胰岛细胞之间存在相互作用,巨噬细胞来源的IL-1β和胰岛细胞分泌的胰岛素协同作用,调控小鼠的葡萄糖代谢稳态,这对系统性抗细菌感染非常重要。

研究人员首先利用脂多糖(LPS)处理野生型和sirt5基因敲除小鼠,发现与野生型小鼠相比,敲除小鼠的血液中葡萄糖浓度显著降低,而胰岛素和IL-1β的浓度显著增加。用氯磷酸-脂质体(Clodronate liposomes)清除巨噬细胞实验和小鼠骨髓移植实验证实腹腔巨噬细胞是IL-1β的主要来源。细胞和分子生物学实验进一步证实SIRT5通过调节巨噬细胞NLRP3炎性小体信号通路以及ROS的产生来调控IL-1β的分泌。相应地,在体外实验中用胰岛素处理巨噬细胞能增加细胞内ROS水平并促进IL-1β的分泌。这些结果提示,在巨噬细胞和胰岛细胞之间存在相互作用,两者协同调控了小鼠体内的葡萄糖稳态。
进一步地,研究者利用LPS刺激小鼠,通过葡萄糖耐受实验(GTT)、胰岛素耐受实验(ITT)、IL-1β抗体中和实验和胰岛细胞体外处理等证明了IL-1β促进Sirt5基因敲除小鼠的胰岛素分泌,而不影响胰岛素敏感性。然而当小鼠体内的葡萄糖稳态被打破后,有什么样的后果呢?
研究者利用鼠伤寒沙门菌(Salmonella typhimurium)感染模型,发现与野生型小鼠相比,Sirt5基因敲除后,小鼠体内的IL-1β增加,胰岛素分泌增加,葡萄糖水平明显下降,小鼠肝脏和脾脏有大量的细菌残留。如果给小鼠补充足量的葡萄糖,能显著降低Sirt5基因敲除小鼠脏器内细菌含量。
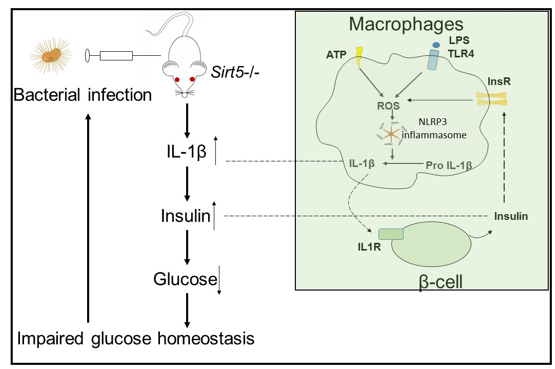
文章模式图
本研究主要由复旦大学生物医学研究院、附属闵行医院和基础医学院医学系统生物学系杨芃原教授和余红秀研究员团队完成。张翠萍博士、王可博士生和胡作建博士生为该论文共同第一作者,杨芃原教授和余红秀研究员为该论文的共同通讯作者。该工作得到了上海大学魏滨教授、复旦大学放射医学研究所邵春林教授、上海交通大学附属瑞金医院王晓教授、广西医科大学秦雪教授和李山教授的大力支持。
杨芃原教授和余红秀研究员团队的研究兴趣之一是免疫细胞代谢在炎癌转化中的功能和分子机制。他们与复旦大学赵世民教授团队合作,发现“SIRT5通过对IDH1和SDH的去琥珀酰化,激活它们的活性,降低了线粒体的琥珀酰化,挽救了线粒体功能,抑制神经胶质瘤细胞代谢和生长”(Molecular cell, 2015,60:1-15);与复旦大学叶丹教授团队合作,发现“SIRT5通过去琥珀酰化调控IDH2、去戊二酰化调控葡萄糖-6-磷酸脱氢酶(G6PD)的活性增强神经细胞的抗氧化能力”(EMBO reports, 2016,17:811-822);2017年,他们发现了SIRT5调控的另一个新底物PKM2。SIRT5通过去琥珀酰化并激活糖酵解的关键酶PKM2,抑制巨噬细胞IL-1β的产生和小鼠结肠炎,阐明了SIRT5调控巨噬细胞代谢在炎症中的重要功能(Cell Reports,2017,19, 2331–2344)。这项工作是他们关于SIRT5在免疫代谢研究中的又一重要发现。
