核糖开关(Riboswitches)是一类非编码RNA元件,主要存在于细菌mRNA的5′非编码区(5′UTR),通常由适配体(aptamer)和表达平台(expression platform)两个功能域组成。当特定分子(ligand,配体)结合适配体域时,会引起表达平台域的局部构象发生变化,从而打开或关闭下游基因的表达。核糖开关广泛存在于细菌中,它们在细菌的硫代谢、辅酶合成、氨基酸合成等基础代谢中发挥着非常重要的调控作用,迄今为止,已有20余类感应不同分子的核糖开关在细菌中被确认。
十字花科黑腐病菌(Xanthomonas campestris pv. campestris,Xcc)属于黄单胞杆菌属革兰氏阴性细菌,是引起十字花科植物(包括重要的蔬菜如白菜、萝卜、甘蓝,重要的油料作物油菜,以及模式植物拟南芥等)黑腐病的病原菌,也是研究微生物与寄主相互作用分子机理的主要模式菌之一。此前的研究发现,在Xcc的合成甲硫氨酸必须的操纵子(met操纵子)mRNA的5′UTR区,存在一段与SAM-I型核糖开关适配体区相似的序列(注:核糖开关多以其识别的配体分子命名,按照RNA二级结构特征又可分为多个亚型),预示在Xcc中Met的合成可能由SAM-I核糖开关控制。但是该潜在的SAM-IXcc核糖开关缺乏已知的核糖开关表达平台的明显特征,其可能的调控功能及机制均不清楚。
近日,我院顾宏周研究团队联合广西大学生命科学与技术学院唐纪良教授团队,研究发现SAM-IXcc RNA在黄单胞菌属中是高度保守的,并且是一类独特的具有双重识别功能的核糖开关:既可以通过适配体区域结合SAM后关闭Met的合成,也可以通过表达平台区域与空载的Met-tRNA互作从而打开Met的合成,且双重感应可以同时发生。换言之,SAM和空载的Met-tRNA同时作用于SAM-IXcc 协调着Met的合成。小分子(SAM)和tRNA同时作用于一个核糖开关协同控制着基因表达是一个全新的发现。6月3日,相关成果以《SAM-I型核糖开关双重感应非荷载的起始tRNA》(SAM-I riboswitch with the ability to sense and respond to uncharged initiator tRNA)为题,在线发表于Nature Communications杂志上。

研究者首先通过融合了SAM-IXcc RNA的reporter体系证实该核糖开关能特异地感应SAM并在翻译水平上起调控作用;进一步的,利用具有单碱基分辨率的in-line probing探测手段,重构了SAM-IXcc RNA的二级/三级结构,发现其与已知的SAM-I核糖开关的结构具有高度相似性;同时,in-line probing实验结果再次确认SAM-IXcc RNA可以很好的结合SAM并区分其类似物SAH或Met(图1)。
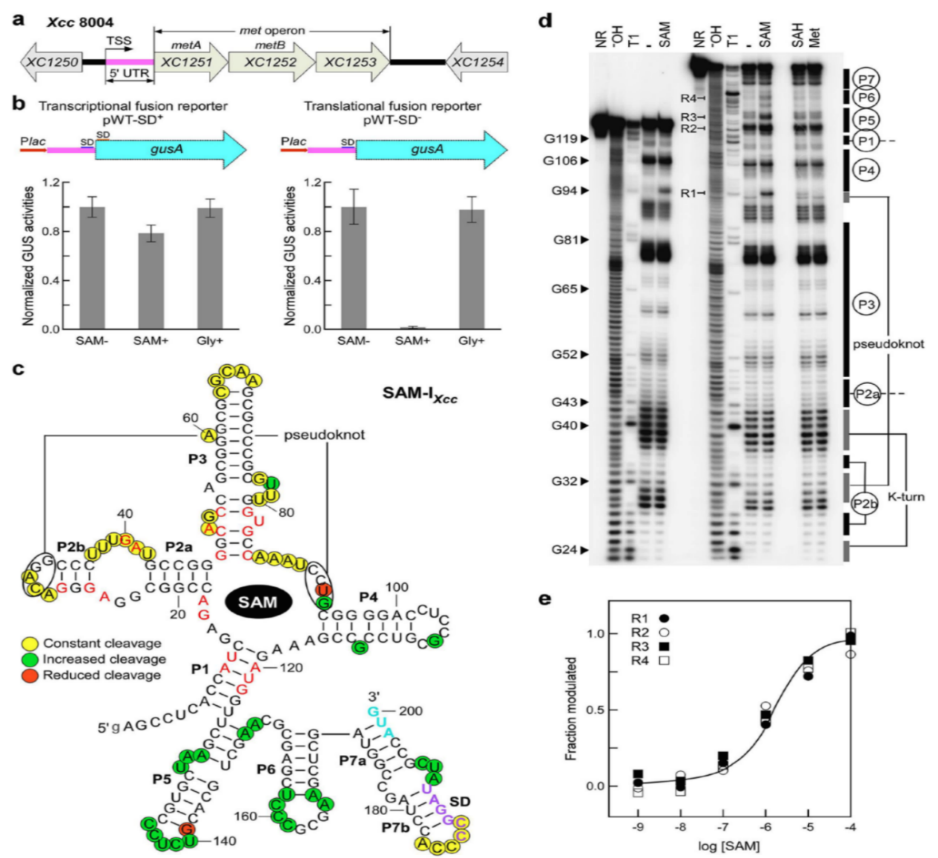
图1. 确认Xcc中的I型SAM核糖开关
研究者很快发现SAM-IXcc 核糖开关结合SAM后可以很好的关闭下游基因表达,反映在核糖体结合位点Shine-Dalgarno(SD)序列以及翻译起始密码子AUG均被屏蔽在稳定的RNA Stem里;然而,在不结合SAM时,整个开关处于“半打开”状态:起始密码子AUG暴露了出来,但是SD序列依然被屏蔽(图2)。这种不彻底的打开较为异常,有别于已知的核糖开关工作原理。这促使研究者思考是否有其它因素共同参与SAM-IXcc 核糖开关的调控?
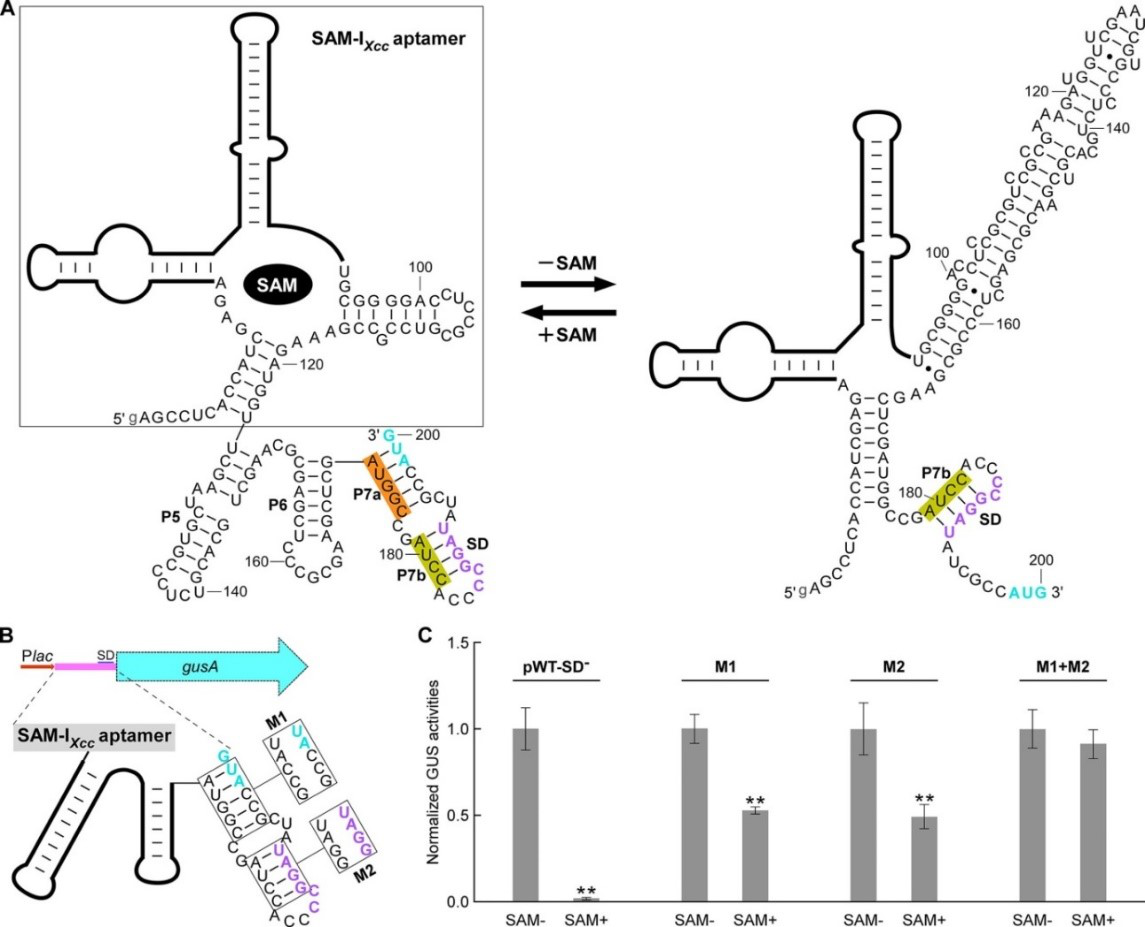
图2. SAM-IXcc 感应SAM并在翻译水平上的调控
在细菌中,已知有两类核糖开关分别调控着Met的合成,SAM核糖开关是其中一类(又称为S Box),另一类为T Box。通常S Box感应到高浓度的SAM后会关闭Met的合成,而T Box感应到积聚的空载Met-tRNA后会打开Met的合成。在Xcc中,SAM-IXcc下游的第一个基因Homoserine O-acetyltransferase(encoded by XC1251,图1a)紧密参与着Met的合成代谢并延伸至负载Met-tRNA的合成(图3),因此研究者猜测空载的Met-tRNA可能就是参与SAM-IXcc 核糖开关SD区打开或屏蔽的其它因素,尽管SAM-IXcc不具备已知T Box的特征序列。
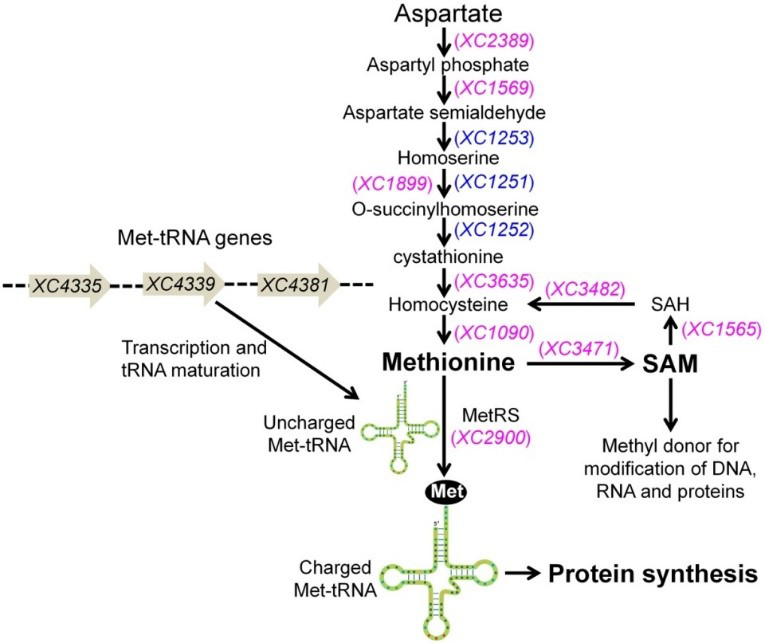
图3. Xcc中Met和SAM的合成及代谢途径
凝胶阻滞实验(EMSA)很快证明了该猜测:SAM-IXcc的表达平台能够与空载的起始Met-tRNA(tRNAfMet)结合,并且这种结合非常特异,Xcc中的其它所有tRNA以及负载了Met的tRNAfMet都不具备这种结合能力;进一步研究发现在SAM-IXcc核糖开关上的结合位点就是屏蔽SD的抗SD序列(anti-SD),当空载的tRNAfMet 结合了SAM-IXcc后,SD序列才得到彻底的释放。但是空载的tRNAfMet通过哪些碱基如何与SAM-IXcc形成特异互作的,目前尚不清晰,有待进一步的研究。
最后,研究者提出了SAM-IXcc的调控模型(图4):当Xcc中的空载tRNAfMet浓度低时,意味着Met浓度高(tRNA都处于装载状态),若此时SAM浓度也高,则SAM结合到SAM-IXcc上完全关闭Met/SAM的合成(OFF),节约原料并合理控制SAM和Met水平;但如果此时SAM浓度低,那么SAM-IXcc则不结合SAM从而半打开Met的合成通路(Partial ON 1),因为Met的浓度已经是足够高的,无须迫切提升Met,当一部分Met被合成转化为SAM后,SAM的浓度自然得到补足而Met的浓度也可以维持在一个合理的水平。类似的,当Xcc中的空载tRNAfMet浓度高时,意味着Met浓度低,若此时SAM浓度也低,则空载的tRNAfMet结合到未结合SAM的SAM-IXcc上,完全释放出SD和AUG序列,核糖开关完全打开Met/SAM的合成(Full On),从而可尽快恢复SAM和Met的水平;但如果此时SAM浓度高,那么SAM-IXcc则同时结合SAM以及空载的tRNAfMet,释放出SD序列但仍屏蔽AUG,从而半打开Met的合成通路(Partial ON 2),一定程度上补足Met的水平即可。

图4. SAM-IXcc的假想工作模型
综上所述,该研究在革兰氏阴性菌中发现了一种新型的SAM-I型核糖开关,它的表达平台区又隐藏着一个感应tRNA的开关。这样的双重开关被认为可以更和谐更合理地调控Met的合成代谢通路,使得相应的细菌在进化的过程中更具备生存优势。这项研究丰富了我们对核糖开关调控机制的认识,也为更好地干预细菌的代谢提供了新的思路。
据悉,生物医学研究院和医学系统生物学系顾宏周研究员和广西大学生命科学与技术学院唐纪良教授为本文的共同通讯作者。唐东阶(广西大学)、杜鑫雨(复旦大学/附属浦东医院)、时强(复旦大学附属中山医院)、张建玲(广西大学/遵义医科大学)为本文共同第一作者。
