长期以来,大脑发育与功能的研究多聚焦于神经元,而对代谢在其中的调控作用知之甚少。尤其各类代谢物如何精确调控胶质细胞的发育与功能,更是领域内的重要空白。谷氨酰胺-谷氨酸循环作为中枢神经系统中至关重要的代谢耦合过程,不仅维持神经递质平衡,更可能潜在地调控神经环路的发育与可塑性。
近日,复旦大学基础医学院秦松教授、附属口腔医院高隽教授与北京脑科学与类脑研究所戈鹉平团队合作,在Protein & Cell上发表了题为“Glutamine synthetase sustains cortical circuit development via mTOR-mediated astrocyte maturation”的研究论文。该研究首次揭示,星形胶质细胞中的关键代谢酶——谷氨酰胺合成酶(GS),通过维持细胞内氨基酸稳态并激活mTOR信号通路,主导星形胶质细胞的成熟进程,从而为大脑皮层神经环路的正常发育提供不可或缺的支撑。复旦大学基础医学院博士、附属口腔医院在站博士后公丕芳为本文第一作者,戈鹉平实验室博士研究生陈晓丽在单细胞测序分析、段树民实验室博士研究生丛玮在电生理记录方面作出重要贡献。
|
|
图1. GS调控星形胶质细胞细胞成熟与突触发育 | 图2. GS缺乏抑制mTOR信号并破坏皮质星形胶质细胞的氨基酸稳态 |
发育时空中的代谢转换
研究团队发现,在胚胎期,GS高表达于神经干细胞中;出生后,其表达迅速切换至星形胶质细胞,且酶活性在星形胶质细胞快速成熟期达到峰值,提示GS在发育不同阶段可能扮演不同角色。
出生后GS缺失导致星形胶质细胞发育迟滞与神经环路缺陷
利用皮层特异性敲除GS的小鼠模型,研究团队观察到,GS缺失对胚胎期神经发生影响不大,但在出生后则引发严重异常。敲除小鼠大脑皮层变薄,星形胶质细胞形态发育受阻,无法形成复杂精细的突起,呈现“不成熟”状态。这直接导致神经元树突生长受阻、突触数量减少、功能减弱,并引发小鼠运动协调与社交行为异常。
关键的挽救实验表明,饮食补充谷氨酰胺可部分改善星形胶质细胞的形态缺陷和突触密度,证明GS通过其催化产物谷氨酰胺发挥核心支持作用(图1)。
锁定失调的mTOR通路
通过单细胞核RNA测序与代谢组学分析,研究发现GS缺失导致星形胶质细胞内谷氨酰胺等氨基酸代谢紊乱,成熟相关基因表达下调,而损伤反应相关基因(如ApoE)异常上调。进一步机制探索显示,mTOR信号通路在GS缺失的星形胶质细胞中被特异性抑制,其下游关键蛋白磷酸化水平显著降低(图2)。
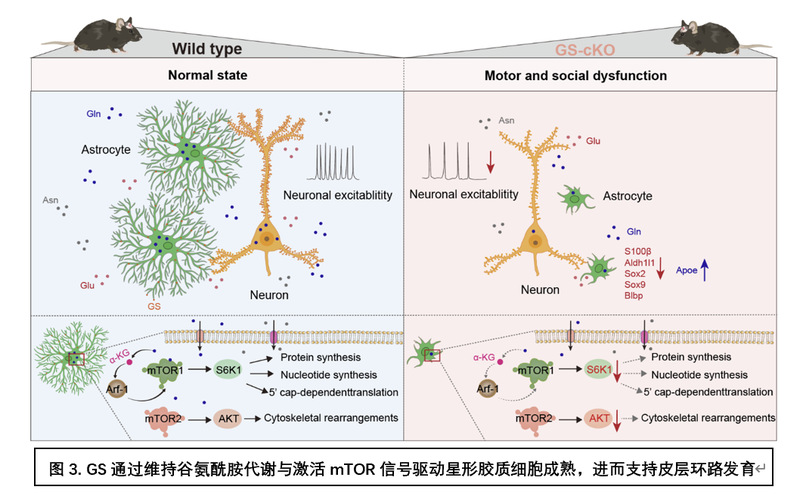
构建“代谢 – 信号 – 功能”因果链
基于上述发现,研究团队提出了明确的机制模型:在出生后关键窗口期,星形胶质细胞通过GS维持谷氨酰胺代谢稳态。充足的谷氨酰胺及其代谢物不仅作为生物合成原料,更作为信号分子激活mTOR通路。活跃的mTOR信号进而驱动星形胶质细胞的合成代谢,支持其完成形态与功能成熟,从而保障突触形成与环路构建。GS缺失则导致该因果链断裂,引发星形胶质细胞发育迟滞及后续神经环路缺陷(图3)。
意义与展望:连接神经发育与疾病的桥梁
该研究阐明了星形胶质细胞内在的代谢检查点机制,揭示mTOR通路对星形胶质细胞自身合成谷氨酰胺的高度依赖。这一发现为理解相关神经发育障碍(如自闭症谱系障碍)提供了新视角:GS功能失调或mTOR信号异常可能导致星形胶质细胞支持功能不足。同时,研究早期观察到的ApoE上调现象,也为探索代谢异常如何增加未来神经退行性疾病风险提供了新线索。
此项研究突破性地揭示了大发育中一个由代谢酶主导的新调控层级:星形胶质细胞通过GS进行内在代谢编程,激活mTOR信号以完成自身成熟,从而为整个皮层神经环路的搭建提供坚实的“基建”支持。该成果不仅深化了对大脑发育代谢调控机制的认识,也为未来靶向胶质细胞代谢干预相关脑疾病提供了新的理论依据。
致谢
本研究得到了国家自然科学基金等项目的资助,并特别感谢浙江大学医学院段树民院士在研究设计与学术讨论中给予的宝贵指导与支持。本研究得到洪文童博士、刘依彤博士以及研究生戚桂波、周雨嫣、宋璇、王振儒、冷展梦等成员的积极协助。
原文链接:https://doi.org/10.1093/procel/pwaf112