EMBO J │基础医学院潘东宁团队发现肝ASPG介导的溶血磷脂酰肌醇分解代谢损害胰岛素信号转导
代谢功能障碍相关脂肪性肝病(MASLD)是全球患病率最高的慢性肝病,MASLD 显著增加2型糖尿病发病风险。生物活性脂质分子溶血甘油磷脂(Lyso-GPLs)参与调节 MASLD 的疾病进程,然而,Lyso-GPLs对肝组织胰岛素敏感性和全身胰岛素信号转导的影响尚未得到广泛研究。
2025年8月4日,复旦大学基础医学院生物化学与分子生物学系、代谢分子医学教育部重点实验室潘东宁团队在EMBO Journal发表题为“Hepatic ASPG-mediated lysophosphatidylinositol catabolism impairs insulin signal transduction” 的研究论文。该研究揭示天冬酰胺酶(Asparaginase, ASPG)通过水解并降低肝细胞内溶血磷脂酰肌醇(LPI)水平,消除了 LPI 对酪氨酸磷酸酶PTP1B活性的抑制作用,进而抑制胰岛素信号转导并促进肝因子 SEPP1 分泌,最终加剧全身胰岛素信号转导障碍。该研究揭示 ASPG 控制的生物活性脂 LPI 水平可调节胰岛素抵抗和胰岛素分泌,为改善全身血糖稳态提供了补充治疗策略。

该研究发现MASLD患者肝脏 ASPG 蛋白水平显著升高,且与患者胰岛素抵抗指数(HOMA-IR)和甘油三酯葡萄糖指数(TyG)呈正相关,提示肝 ASPG 参与调节 MASLD 发生时胰岛素信号转导缺陷。动物实验表明,肝细胞 Aspg 过表达显著加重小鼠全身胰岛素信号转导紊乱,而肝细胞特异性敲除 Aspg则保护肥胖小鼠胰岛β细胞功能,并提高主要代谢组织胰岛素敏感性。
机制研究显示 ASPG 在体外和体内都表现出特异性水解 LPI 的溶血磷脂酶活性。敲除 Aspg引起小鼠肝细胞内 LPI 总量升高,LPI 通过空间位阻效应抑制酪氨酸磷酸酶 PTP1B 的催化活性,从而增强了肝细胞中的胰岛素信号转导,降低肝因子 SEPP1 的表达和分泌。相反,肝细胞内过表达 Aspg则增加血液中 SEPP1 水平。SEPP1 作为促胰岛素抵抗的关键肝因子,可作用于胰腺,骨骼肌和脂肪等组织,抑制胰腺胰岛素分泌和骨骼肌以及脂肪组织内胰岛素信号转导,加重全身性胰岛素抵抗。值得注意的是,本研究发现肝细胞内 LPI 可直接结合并抑制PTP1B 活性,以不依赖于 LPI 受体 GPR55 的方式发挥作用,这与经典的 LPI-GPR55 作用模式完全不同,表明溶血磷脂分子 LPI 具有多种生物活性。
为了进一步验证 ASPG-LPI-胰岛素信号轴的临床转化价值,该研究还靶向敲除了 MASLD 小鼠肝细胞内 Aspg ,丧失 ASPG 后小鼠的糖耐量、胰岛素分泌能力以及全身胰岛素敏感性均得到显著改善。总之,该研究以明确的实验证据表明肝细胞 ASPG 在MASLD背景下成为胰岛素信号转导缺陷的“助推器”,降低 ASPG表达水平是增强全身葡萄糖稳态的潜在途径。
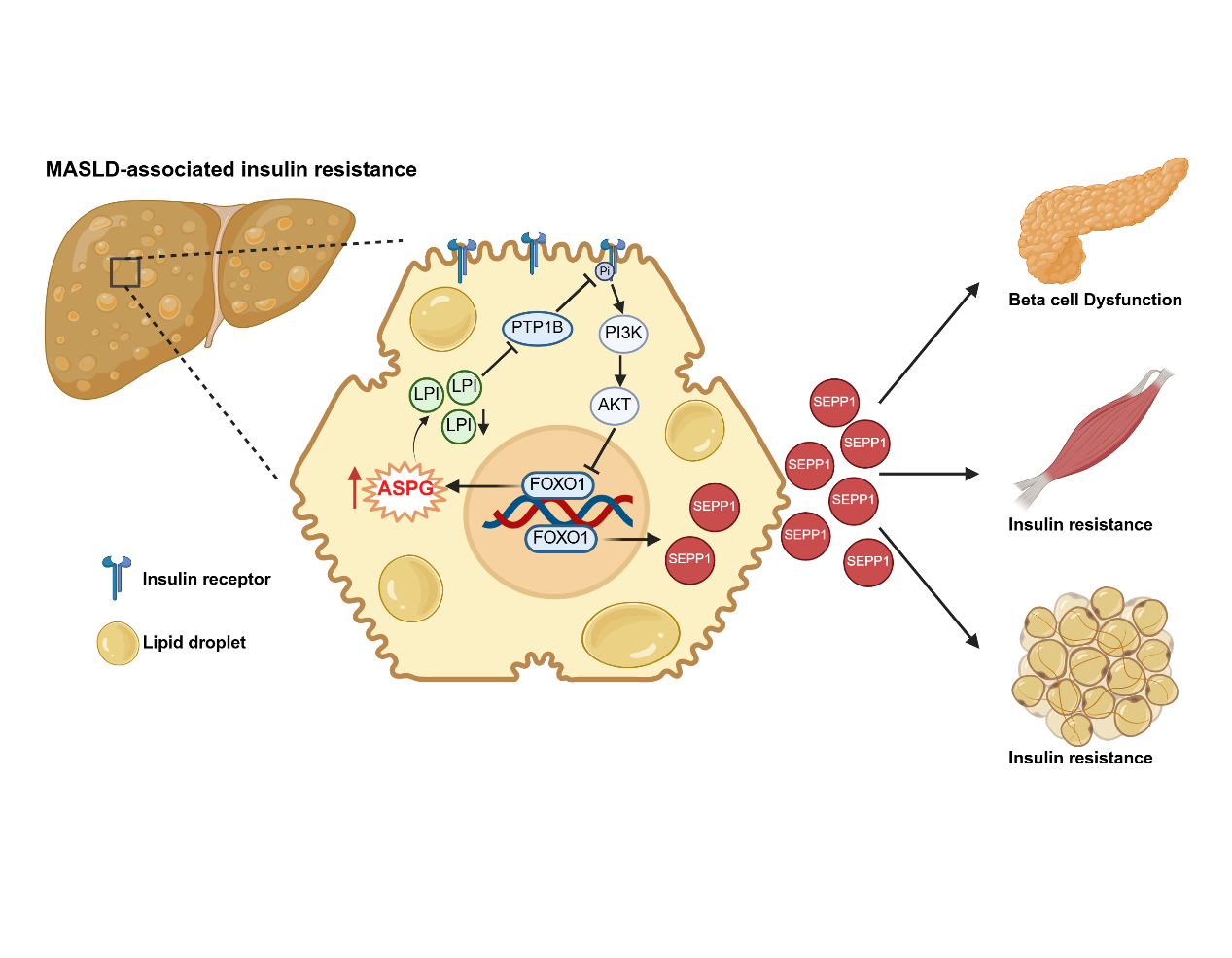
图1:MASLD患者的肝细胞高表达ASPG,ASPG水解LPI,解除LPI对PTP1B磷酸酶活性的抑制,进而阻碍肝细胞内胰岛素信号转导并增加肝因子SEPP1表达。SEPP1促进肝外组织胰岛素抵抗和胰岛素分泌缺陷。
复旦大学基础医学院潘东宁研究员为该研究通讯作者,基础医学院博士研究生李飞彦为第一作者。该研究获得国家自然科学基金等项目资助。复旦大学附属中山医院李小英教授、陆炎教授为该研究提出宝贵建议,广西医科大学附属第一医院彭涛教授为该研究提供重要临床样本支持。
原文链接:
https://www.embopress.org/doi/full/10.1038/s44318-025-00525-x






