Cell Reports | 汤其群/郭亮团队揭示线粒体蛋白HIGD1A促进脂肪组织棕色化的作用和机制
随着社会经济的发展、高能量饮食摄入的增加和人们生活方式的改变,肥胖已经成为世界范围内的一大公共健康问题。脂肪组织分为三种类型,其中白色脂肪负责储存能量,棕色和米色脂肪可以将营养物质代谢产生的能量以热能的形式释放,用于维持体温。在寒冷刺激、肾上腺素能受体活化等情况下白色脂肪组织可以向棕色或者米色脂肪组织转化,这一过程称之为脂肪组织的棕色化(米色化)。棕色化的脂肪组织能够和棕色脂肪组织一样产热耗能、改善代谢。脂肪组织的棕色化受到精密的生物学调控。深度解析脂肪组织棕色化的调控网络,阐明其中的分子机制,将有助于我们寻找更加安全有效的调控脂肪组织代谢功能活化的分子靶点或者方法,为防治肥胖及其相关代谢性疾病提供新的思路和策略。

2023年7月1日,汤其群/郭亮团队在Cell Reports上发表了题为HIGD1A links SIRT1 activity to adipose browning by inhibiting the ROS/DNA damage pathway的研究成果。该研究发现脂肪组织HIGD1A受到寒冷刺激诱导上调,能够抑制脂肪细胞活性氧(ROS)水平、减少DNA损伤,进而通过上调NAD+/NADH比例激活去乙酰化酶SIRT1,促进小鼠脂肪组织棕色化和棕色脂肪组织活化,增强小鼠寒冷耐受能力和能量消耗,进一步抵抗小鼠肥胖及代谢紊乱。
研究团队为了深入探索米色/棕色脂肪组织激活的分子机理,分离了4℃冷暴露24小时和室温饲养小鼠的皮下脂肪组织以及分化成熟的棕色脂肪细胞(分化第6天)和前棕色脂肪细胞(-2天),进行RNA-seq检测和分析比较1,从中筛选鉴定出候选效应分子缺氧诱导基因域蛋白-1a(Hypoxia-induced gene domain protein-1a, HIGD1A)。与室温组小鼠相比,冷暴露后的小鼠皮下/棕色脂肪组织中HIGD1A表达显著增加,β3-肾上腺素能受体激动剂CL316,243同样能够刺激HIGD1A表达的显著上调。进一步的研究还发现,HIGD1A主要在脂肪组织的成熟脂肪细胞中表达;冷暴露能够促进其在成熟脂肪细胞组分中表达的上调。
前人研究表明,HIGD1A参与调节多种生理和病理过程。HIGD1A缺失导致线粒体过度分裂、线粒体DNA (mtDNA)缺失、线粒体嵴紊乱和细胞生长迟缓2。另有研究表明,HIGD1A通过特异性结合视神经萎缩蛋白1 (Optic atrophy 1, Opa1)并保持Opa1的完整性来发挥作用3。最近的研究表明,HIGD1A通过抑制胞质ox-mtDNA/NLRP3炎症小体/JNK通路可以促进运动对非酒精性脂肪性肝病(NAFLD)的缓解4。尽管HIGD1A已被认为能够改善肝脏代谢,但HIGD1A在脂肪组织代谢中的作用尚不明确。
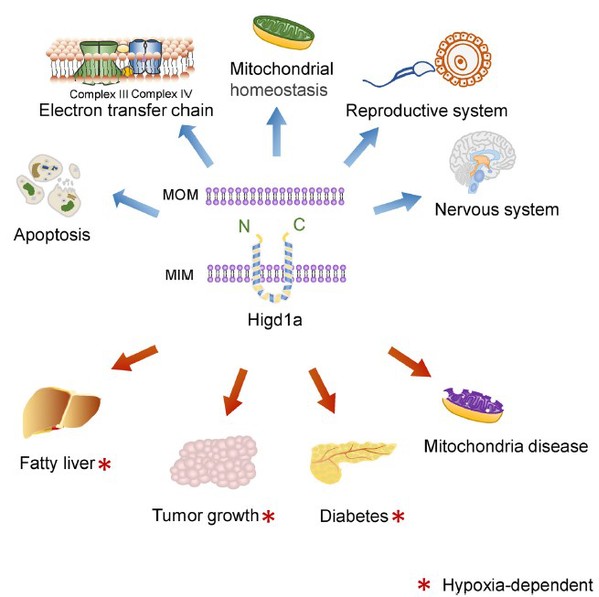
HIGD1A调节多种生理和病理过程5
HIGD1A是一个进化保守的基因,在哺乳动物的多种组织中广泛表达。越来越多的研究揭示了HIGD1A作为线粒体内膜蛋白在调节代谢稳态中的多种功能。在缺氧条件下,它在多种类型细胞中发挥抗凋亡和促进细胞存活的作用。在某些情况下,HIGD1A可以作为代谢应激的标志5。本项研究中,研究人员采用皮下脂肪组织/棕色脂肪组织特异性敲低HIGD1A小鼠(局部注射AAV-shHigd1a)以及皮下脂肪组织/棕色脂肪组织特异性过表达HIGD1A小鼠(局部注射AAV-Higd1a),对HIGD1A在脂肪组织中发挥的功能进行了深入的研究。
研究人员发现,HIGD1A受冷暴露诱导上调,其转录表达受PPARγ与共激活因子PGC1α的协同诱导。在体外脂肪细胞实验中,通过敲低/过表达HIGD1A,发现HIGD1A能够促进白色脂肪细胞棕色化以及棕色脂肪细胞的功能活化。研究团队发现HIGD1A通过促进呼吸链复合体IV的活力和电子传递链的效率降低脂肪细胞中ROS水平,进而减轻DNA损伤,减少多聚ADP核糖转移酶PARP-1对NAD+的消耗,提高NAD+/NADH比例,增加去乙酰化酶SIRT1的酶活性,进而通过对PPARγ等棕色化相关的重要转录因子的去乙酰化,促进其下游棕色化相关基因的表达。研究人员通过局部注射AAV-shHigd1a敲低小鼠皮下脂肪组织/棕色脂肪组织中的HIGD1A后,发现小鼠脂肪组织棕色化以及棕色脂肪组织活力显著降低、小鼠能量消耗显著减少、对寒冷刺激不耐受,且更容易发生高脂饮食喂养诱导的肥胖及相关代谢紊乱(糖耐量受损、胰岛素抵抗、血脂异常等)。与之相反的是,通过局部注射AAV-Higd1a在小鼠皮下脂肪组织/棕色脂肪组织中过表达HIGD1A后,小鼠脂肪组织棕色化和棕色脂肪组织活力明显增强,且小鼠能量消耗及寒冷耐受能力得到提高,并有效抵抗高脂饮食喂养诱导的肥胖及相关代谢紊乱。
该研究揭示了HIGD1A在脂肪组织棕色化、棕色脂肪组织功能活化及适应性产热中的重要促进作用,发现了HIGD1A抑制ROS/DNA损伤、提高NAD+/NADH比例、增强SIRT1酶活性进而促进脂肪组织棕色化的新调节路径,阐明了线粒体内膜蛋白HIGD1A调控脂肪细胞代谢功能活化的新功能和新机制,为预防和治疗肥胖及相关代谢紊乱提供了新的思路和干预靶点。
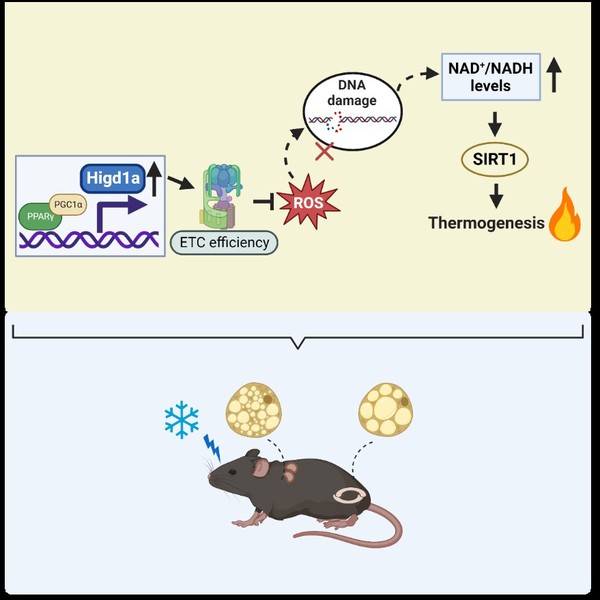
HIGD1A促进脂肪组织棕色化的作用和机制模式图(图片已获BioRender授权)
复旦大学基础医学院2018级直博生李白玉、2018级博士研究生彭婉秋为本文的共同第一作者,复旦大学基础医学院汤其群教授和上海体育大学运动健康学院郭亮教授为本文的共同通讯作者。
原文链接:https://doi.org/10.1016/j.celrep.2023.112731
参考文献
Ding, M., Ma, Y.J., Du, R.Q., Zhou, W.Y., Dou, X., Yang, Q.Q., Tang, Y., Qian, S.W., Liu, Y., Pan, D.N., et al. (2022). CHCHD10 Modulates Thermogenesis of Adipocytes by Regulating Lipolysis. Diabetes 71, 1862-1879. 10.2337/db21-0999.
Hayashi, H., Nakagami, H., Takeichi, M., Shimamura, M., Koibuchi, N., Oiki, E., Sato, N., Koriyama, H., Mori, M., Gerardo Araujo, R., et al. (2012). HIG1, a novel regulator of mitochondrial gamma-secretase, maintains normal mitochondrial function. FASEB J 26, 2306-2317. 10.1096/fj.11-196063.
An, H.J., Cho, G., Lee, J.O., Paik, S.G., Kim, Y.S., and Lee, H. (2013). Higd-1a interacts with Opa1 and is required for the morphological and functional integrity of mitochondria. Proc Natl Acad Sci U S A 110, 13014-13019. 10.1073/pnas.1307170110.
Zhu, J.Y., Chen, M., Mu, W.J., Luo, H.Y., and Guo, L. (2022). Higd1a facilitates exercise-mediated alleviation of fatty liver in diet-induced obese mice. Metabolism 134, 155241. 10.1016/j.metabol.2022.155241.
Zhu, J.-Y., Chen, M., Mu, W.-J., Luo, H.-Y., and Guo, L. (2022). The functional role of Higd1a in mitochondrial homeostasis and in multiple disease processes. Genes & Diseases. 10.1016/j.gendis.2022.03.018.






