Nature Metabolism│汤其群教授团队发现巨噬细胞促进脂肪组织产热的新机制
动物体内不仅存在储存能量的白色脂肪,也存在消耗能量的棕色脂肪或米色脂肪;棕色或米色脂肪细胞将营养物质代谢产生的能量转化为热能,用于维持体温。人体内经典的棕色脂肪只出现在婴幼儿时期,而米色脂肪在成年人体内广泛分布,在一定条件下(如冷刺激和运动)被激活。米色脂肪激活最基本的生理意义是冷适应(cold adaptation/acclimation);另外其激活程度与体重和代谢状态密切相关,因此诱导米色脂肪激活以增加能量消耗,是一种潜在的减肥手段。脂肪组织内除了脂肪细胞,还有免疫细胞、神经细胞、内皮细胞、干细胞等多种细胞,因此米色脂肪的激活过程是各种细胞协调作用的结果,而细胞间的交流过程复杂,值得探索。
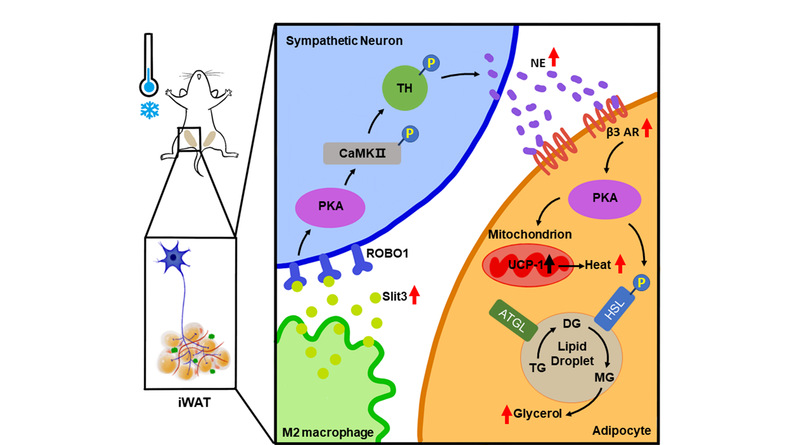
2021年11月15日,复旦大学汤其群/钱淑文团队在Nature Metabolism上发表了题为Slit3 secreted from M2-like macrophages increases sympathetic activity and thermogenesis in adipose tissue的研究成果。该研究发现,脂肪组织内M2样巨噬细胞分泌Slit3蛋白,结合交感神经上的受体Robo1,激活Ca2+/CaMKⅡ通路促进去甲肾上腺素分泌,从而增加脂肪细胞的分解代谢和产热,提高小鼠的冷耐受能力。该研究提出了M2巨噬细胞/Slit3/交感神经/脂肪细胞轴这一米色脂肪激活新机制。

脂肪组织内的巨噬细胞(adipose tissue macrophages,ATMs)对于脂肪组织的发育、代谢功能具有重要调节作用。巨噬细胞根据活化状态可分为致炎性的M1样巨噬细胞和抗炎性的M2样巨噬细胞。已有的研究(包括发现该研究团队之前的研究成果)发现米色脂肪的激活伴随着M2样巨噬细胞的增加 [1-3]。虽然两者的正相关性是明确的,但关于巨噬细胞作用于其它细胞的直接证据很少。曾有研究认为巨噬细胞通过分泌儿茶酚胺类物质促进脂肪细胞的类棕色活性 [4],但很快被另一项研究否定,证据是巨噬细胞产生的儿茶酚胺很低,不足以激活米色脂肪细胞 [5]。该团队用骨髓来源的M2巨噬细胞(BMDM-M2)的条件培养基处理脂肪组织,发现其可以促进脂肪组织产热基因UCP1表达升高,血管新生等米色脂肪激活的特征变化;另外, M2型巨噬细胞移植到体内也能促进白色脂肪米色化,增加小鼠的整体代谢率 [3]。以上结果提示巨噬细胞能够通过旁分泌的作用影响其它细胞,在米色脂肪激活中发挥作用。
为了探究这一问题,首先需要筛选巨噬细胞分泌因子。为了能将符合生理变化的分泌因子筛选出来,研究团队又回到体内寻找冷适应时脂肪组织巨噬细胞差异变化的基因。他们分别分离了4℃冷暴露3天和室温饲养小鼠皮下脂肪组织,用流式细胞技术分选其中的M2巨噬细胞,进行RNA-sequence检测,进而比较两组差异表达的基因, KEGG分析有显著性变化的信号通路是Axon guidance,其中的一些基因表达的蛋白是分泌蛋白,团队把目标集中在表达量最高的分泌蛋白Slit3(slit guidance ligand 3)上。
那么Slit3靶向的是哪种细胞?如何发挥功能?利用巨噬细胞条件培养基处理脂肪细胞或者交感神经细胞,或者巨噬细胞和其它细胞的共培养体系,结合检测体内Slit3受体Robo1的表达分布,以及去神经能够阻断Slit3促进米色脂肪激活的作用,该研究团队确定Slit3作用的细胞是交感神经。Slit3激活交感神经Ca2+/CaMKⅡ通路促进去甲肾上腺素的合成和分泌,进而促进脂肪细胞分解代谢和产热基因表达。同时巨噬细胞特异敲除Slit3的小鼠表现为冷不耐受和体重增加,这些结果也支持巨噬细胞分泌蛋白Slit3激活米色脂肪的作用。
本研究交叉结合了生物化学(脂肪代谢),免疫学(巨噬细胞),神经生物学(交感神经)的等多领域研究,首次发现了脂肪组织M2样巨噬细胞/Slit3/交感神经/脂肪细胞轴的作用。这一研究结果揭示了脂肪组织产热的新机制,完善了我们对于机体冷气候适应方式的认知,为寻找预防和治疗肥胖的手段提供新思路。
复旦大学基础医学院18级博士生王艺娜是本文的第一作者,基础医学院汤其群教授和钱淑文副研究员是本文的共同通讯作者。本项目受科技部重点研发项目,国家自然科学基金重点和面上项目资助。
原文链接
https://doi.org/10.1038/s42255-021-00482-9
参考文献
2. Qian Shuwen, et al., BMP4-mediated brown fat-like changes in white adipose tissue alter glucose and energy homeostasis. PNAS, 2013.2.26, 110(9): E798~E807.
5. Fischer, K., et al., Alternatively activated macrophages do not synthesize catecholamines or contribute to adipose tissue adaptive thermogenesis. Nat Med, 2017. 23(5): p. 623-630.






