Advanced Science│潘东宁团队揭示PWWP2B蛋白在调控脂肪组织产热功能中的重要作用
哺乳动物体内存在两种具有产热功能的脂肪组织,即棕色脂肪组织和米色脂肪组织。产热脂肪组织通过激活或抑制产热基因的表达,响应生理状态的改变和环境温度的刺激,进而调控机体的代谢稳态。转录和表观遗传调控因子通过改变特定基因启动子上的组蛋白标记和染色体结构进而调控适应性产热进程[1]。组蛋白乙酰化是最丰富的表观遗传标记之一,对转录产生重要影响,组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)协同控制特定染色质位点乙酰化水平的动态转换。HDACs广泛参与肿瘤发生、免疫紊乱、神经退行性疾病发生等过程,也调控棕色和米色脂肪生理功能[2]。已有研究报道,HDAC1通过去除组蛋白H3K27上的乙酰化修饰,增加H3K27me3修饰,从而负向调控棕色脂肪特异性基因的激活[3]。然而,脂肪细胞中HDACs 如何结合到特定基因转录起始区来调节产热过程尚不明确。
近日,复旦大学代谢分子医学教育部重点实验室PI、基础医学院生物化学与分子生物学系潘东宁研究员课题组在Advanced Science杂志上在线发表题为“PWWP2B Fine-Tunes Adipose Thermogenesis by Stabilizing HDACs in a NuRD Subcomplex”的研究论文。该研究利用Adiponectin-Cre驱动Pwwp2b脂肪组织特异性敲除鼠模型及棕色脂肪细胞系等,揭示了PWWP2B在棕色/米色脂肪组织中通过招募并稳定组蛋白去乙酰化酶HDAC1/2,负向调控脂肪组织产热功能。

Pwwp2b基因在棕色脂肪组织中高表达,并且其表达水平进一步受寒冷刺激诱导,但对该基因的功能鲜有报道。为了探究Pwwp2b在脂肪组织中的功能,作者构建了Adiponectin-Cre驱动的Pwwp2b脂肪组织特异性敲除鼠模型。Pwwp2b基因敲除鼠在寒冷环境中维持体表温度的能力更强;而在30℃热中性环境中,敲除鼠棕色脂肪组织中产热相关基因的表达显著上调;应对β3肾上腺素能受体激动剂刺激,基因敲除鼠的白色脂肪米色化程度更显著,脂肪细胞内脂滴更小,脂肪组织耗氧能力更强;对野生鼠和敲除鼠进行高脂饲料喂养后,敲除鼠体重增长缓慢,脂肪组织、肝脏敏感响应胰岛素刺激。此外,在体外培养前棕色脂肪细胞系中,借助shRNA敲低Pwwp2b基因,可见分化成熟的棕色脂肪细胞内产热相关基因表达显著上升,耗氧能力增加。因此,作者认为Pwwp2b在脂肪细胞中发挥负向调控非颤栗性产热的功能。
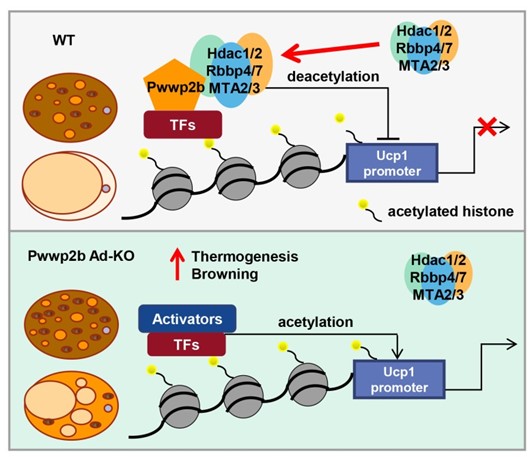
为了进一步探究Pwwp2b发挥功能的分子机制,作者首先证实PWWP2B蛋白定位在细胞核中,通过染色质免疫共沉淀技术揭示PWWP2B可结合于Ucp1等产热基因的启动子区域。通过质谱技术鉴定与PWWP2B相互作用的蛋白,发现PWWP2B存在于核小体重塑和去乙酰化复合物中 (NuRD),通过结合并稳定组蛋白去乙酰化酶HDAC1/2,降低基因启动子区乙酰化水平,进而发挥负向调控脂肪细胞产热的功能。
值得一提的是,尽管PWWP2B在功能上被证实对脂肪组织产热功能实施负调控作用,但Pwwp2b在棕色脂肪组织中表达水平显著高于白色脂肪组织,且寒冷刺激和交感神经兴奋可以进一步诱导Pwwp2b的表达,表明PWWP2B是棕色脂肪细胞内在的产热反应“刹车”装置,可有效避免棕色和米色脂肪细胞产热功能的过度激活。本研究为以组蛋白去乙酰化酶复合物为靶点,治疗肥胖、糖尿病等代谢性疾病提供新的思路。
复旦大学基础医学院博士研究生闫林雨、硕士研究生金蔚蔚为本论文共同第一作者,潘东宁研究员为通讯作者。此课题得到科技部重点研发项目(2018YFA0800401)、国自然面上项目等支持。
原文链接:https://doi.org/10.1002/advs.202102060
[1] T. Inagaki, J. Sakai, S. Kajimura, Nat Rev Mol Cell Biol 2016, 17, 480.
[2] K. J. Falkenberg and R. W. Johnstone, Nature reviews. Drug discovery 2014, 13, 673.
[3] F. Li, R. Wu, X. Cui, L. Zha, L. Yu, H. Shi, B. Xue, J Biol Chem 2016, 291, 4523.






