Cell Reports | 复旦大学汤其群/汤妍团队:内脏脂肪外泌体miRNA在动脉粥样硬化性疾病中的作用及机制研究
动脉粥样硬化是一种复杂的心血管疾病,由动脉内部脂质代谢紊乱和炎症引起,目前在全球范围内仍是老年人死亡的主要原因。中国慢性病前瞻性研究(24822名成年人的颈动脉硬化进行横断面检测)发现约1/3中国成人存在颈动脉斑块。基于动脉粥样硬化性疾病是老年常见疾病,发生率和死亡率都很高,因此研究其背后的作用机理,寻找治疗和预防的药物靶点,对于控制相关疾病的发生发展具有重要的意义。
大量人群队列分析发现内脏脂肪组织的含量是心血管疾病的独立危险因素。肥胖发生时,脂肪细胞可以分泌促炎因子(肿瘤坏死因子TNFα,白细胞介素IL-6等)诱导内皮细胞炎症反应。但是这些炎性因子并不是特异性来源于内脏脂肪,也不能针对这些机理开发有效的防治措施。外泌体是一种直径在30-110nm之间的杯装囊泡,有脂质层包裹,通过转运活性物质(蛋白、核酸、脂质等)协调细胞间、器官间的交流。外泌体的内容物具有一定的细胞来源特异性及靶向特异性,因此分析内脏脂肪外泌体miRNA有望开发针对内脏脂肪的特异性防治靶点。
近日,复旦大学汤其群团队从内脏脂肪外泌体中筛选到miR-27b-3p可以特异性作用到血管内皮细胞,促发内皮细胞炎症反应及动脉粥样硬化的发生。该研究成果以“Exosomal miR-27b-3p secreted by visceral adipocytes contributes to endothelial inflammation and atherogenesis”为题发表在Cell Reports杂志上(2023 Jan 5;42(1):111948)。该研究系统证实了肥胖促进内脏脂肪外泌体miR-27b-3p分泌入血,通过下调内皮细胞中PPARα的表达,促进内皮细胞炎症及动脉粥样硬化的发生。该文第一作者是复旦大学青年副研究员汤妍,博士生杨丽洁,交通大学新华医院刘浩医生;通讯作者是复旦大学汤其群教授。

该团队首先建立了脂肪组织的外泌体分离方法,将脂肪组织在体外培养3天后,通过经典的超速离心方法,得到外泌体成分。通过电子电镜、NTA颗粒检测、Western blot等方法对外泌体进行了不同角度的鉴定,从而保证外泌体的分离是稳定有效的。接着采用三种肥胖小鼠模型(高脂饮食诱导、Ob/ob、Db/db),分离内脏脂肪组织的外泌体成分。发现肥胖可以引起内脏脂肪组织外泌体的大量分泌,并鉴定了一系列在肥胖状态时表达变化的miRNA。
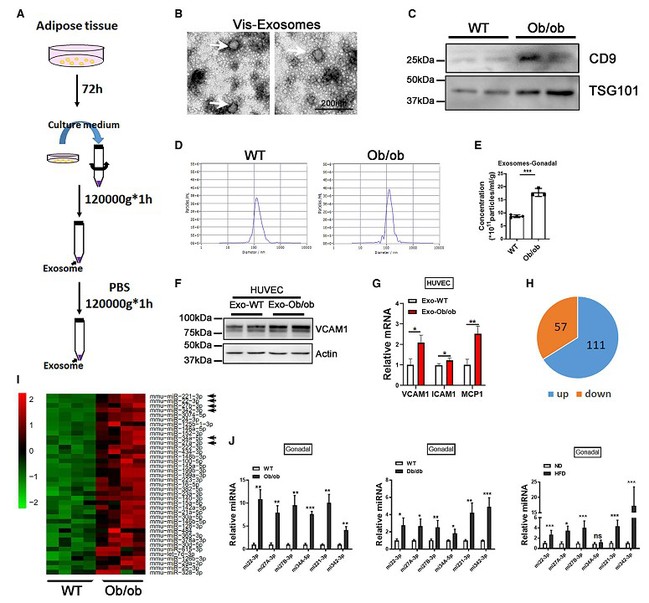
肥胖诱导内脏脂肪外泌体miRNA的变化谱。
其中miR-27b-3p同时在内脏脂肪和血清外泌体中出现了高表达,并对血管内皮细胞有特异性的促炎作用。接着通过一系列体外实验,发现miR-27b-3p主要表达在成熟的脂肪细胞中,并可被分泌出来。在冠心病人群的血清中发现外泌体miR-27b-3p的含量与BMI和腰围成正比。进一步的细胞共培养实验发现miR-27b-3p可以被包裹在外泌体中分泌,并被内皮细胞吸收,但却不影响外泌体的颗粒数。miR-27b-3p并不影响脂肪细胞本身的分化成熟,但从脂肪细胞中分泌出来后,可以促进内皮细胞的炎症反应,并且这种炎症反应可以被外泌体的抑制剂以及miR-27b-3p的拮抗剂所阻断。从机制方面来说,miR-27b-3p通过结合在PPARa的CDS区域,下调PPARa的表达。在小鼠体内,过表达miR-27b-3p可以促进动脉粥样硬化的发生。相反,促进PPARa的表达抑制动脉粥样硬化的发生。
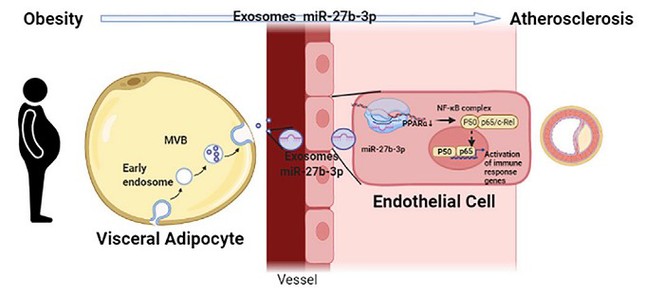
内脏脂肪外泌体发挥作用的模式图
研究团队系统验证了miR-27b-3p及其靶基因PPARα对动脉粥样硬化的作用效果及机制研究。在临床上,PPARα激动剂贝特类药物主要是用于降低血脂,但治疗效果有限。这是否跟病人血管内皮中PPARα的表达下调有关?未来,该团队拟进一步研究PPARα激动剂贝特类药物对不同类型动脉粥样硬化性疾病的治疗效果及机制进行进一步相关性研究,以期对动脉粥样硬化性疾病的防治有一定的推动作用。
参考文献:
Tang Y, Yang LJ, Liu H, Song YJ, Yang QQ, Liu Y, Qian SW, Tang QQ. Exosomal miR-27b-3p secreted by visceral adipocytes contributes to endothelial inflammation and atherogenesis. Cell Rep. 2023 Jan 5;42(1):111948. doi: 10.1016/j.celrep.2022.111948. Epub ahead of print. PMID: 36640325.






