PNAS | 汤其群/刘洋团队揭示细胞因子CLCF1抑制棕色脂肪细胞产热新机制
肥胖及其相关代谢性疾病是当前全球健康面临的重大挑战之一。在哺乳动物体内,白色脂肪细胞专门负责储存和释放脂质,而经典的棕色脂肪细胞能够以热能的形式消耗能量。米色脂肪细胞是存在于白色脂肪组织内的可诱导产热脂肪细胞,在受到外界刺激(如寒冷、肾上腺素刺激或锻炼)后获得产热表型。研究显示,人体内棕色脂肪组织的含量和活性与2型糖尿病、血脂异常和冠心病等疾病发生率呈现负相关 (1)。目前,激活产热脂肪细胞从而增加机体能量消耗,被认为是一种对抗肥胖及相关代谢性疾病有效策略。然而,激活肥胖个体的产热脂肪面临多重困难,一些尚属未知的产热脂肪负向调节信号是阻碍产热脂肪的活化的重要因素。

2023年8月7日,汤其群/刘洋团队在PNAS上发表了题为CLCF1 signaling restrains thermogenesis and disrupts metabolic homeostasis by inhibiting mitochondrial biogenesis in brown adipocytes的研究成果,揭示了一条肥胖诱导的抑制产热脂肪活化的信号通路。
该研究首先对寒冷诱导的产热脂肪组织进行了转录组学分析,以寻找产热调节因子,为了探索产热抑制信号,研究人员关注了在产热激活期间下调的分泌因子,并发现心营养素样细胞因子1(CLCF1)显著降低。CLCF1属于白细胞介素(IL)-6家族的细胞因子,在器官发育、肿瘤发生和运动神经元存活中发挥着重要作用 (2, 3)。然而,CLCF1及其下游信号在脂肪组织中的功能尚不清楚。该研究发现CLCF1表达水平在肥胖发生过程中显著增加,在产热脂肪活化时显著降低。研究人员构建了脂肪细胞特异性过表达CLCF1的转基因(CLCF1-TG)小鼠,发现该小鼠相较于对照组表现出非常严重的冷不耐受,棕色脂肪组织发生白色化,线粒体生成严重受损,小鼠整体能量消耗水平显著降低。机制研究发现,CLCF1激活脂肪细胞睫状神经营养因子受体(CNTFR)并增强下游信号转导和转录激活因子3(STAT3)信号通路活性,STAT3转录抑制PGC1-α及PGC1-β表达,降低线粒体生物发生从而促进棕色脂肪组织的白色化,导致小鼠冷不耐受和能量消耗水平下降。在代谢表型方面,CLCF1-TG小鼠在普通饮食喂养下就表现出显著的糖脂代谢异常。阻断CNTFR或STAT3能够显著促进小鼠产热脂肪的活化,改善机体代谢状态。
该研究揭示了细胞因子CLCF1在棕色脂肪组织非颤抖产热中的抑制作用,发现了CLCF1结合并激活CNTFR信号、增强STAT3信号抑制线粒体生物发生进而抑制棕色脂肪组织功能活化的新调节路径,阐明了细胞因子CLCF1调控棕色脂肪细胞代谢的新功能和新机制,为治疗肥胖及相关代谢疾病和维持系统性代谢稳态提供了新的思路和干预靶点。
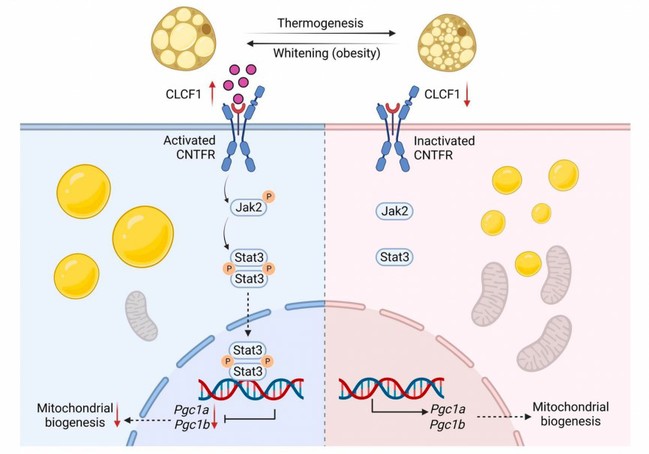
CLCF1促进棕色脂肪组织白色化的作用和机制模式图(图片已获BioRender授权)
复旦大学代谢分子医学教育部重点实验室博士后丁萌、复旦大学基础医学院2021级硕士研究生徐红玉为本文的共同第一作者,复旦大学基础医学院汤其群教授和刘洋副教授为本文的共同通讯作者。
原文链接:https://doi.org/10.1073/pnas.2305717120
1. W. Wang, P. Seale, Control of brown and beige fat development. Nat Rev Mol Cell Biol 17, 691-702 (2016).
2. S. A. Jones, B. J. Jenkins, Recent insights into targeting the IL-6 cytokine family in inflammatory diseases and cancer. Nat. Rev. Immunol. 18, 773-789 (2018).
3. J. W. Kim, et al., Antitumor activity of an engineered decoy receptor targeting CLCF1-CNTFR signaling in lung adenocarcinoma. Nat. Med. 25, 1783-1795 (2019).






