AJHG/JECCR | 卫功宏及其合作团队共同揭示前列腺癌遗传风险相关位点的基因调控机制
目前,研究人员利用全基因组关联分析(GWAS)和表达数量性状基因座(eQTL)等研究手段,发现了大量复杂疾病包括肿瘤风险相关的易感位点和潜在致病基因。尽管这些研究成果显著增加了人们对疾病易感性的理解,但所识别的风险单核苷酸多态性位点(SNP)大多位于非编码基因组区,其背后蕴含的生物学机制和临床意义往往难以解释。
2023年8月3日,复旦大学基础医学院生化系代谢分子医学教育部重点实验室卫功宏团队与莫菲特癌症中心王亮团队联合在American Journal of Human Genetics上发表了题为“Combined CRISPRi and proteomics screening reveal a cohesin-CTCF-bound allele contributing to increased expression of RUVBL1 and prostate cancer progression”的研究成果。该研究通过大规模CRISPRi文库筛选联合蛋白质组学分析以及功能实验等手段,阐释rs60464856参与的基因调控机制及其靶基因RUVBL1在前列腺癌进展中的作用,这一结果丰富了我们对肿瘤易感性生物学机制的认识,并可能为癌症风险分层和挖掘个性化治疗的潜在靶点提供重要启示。
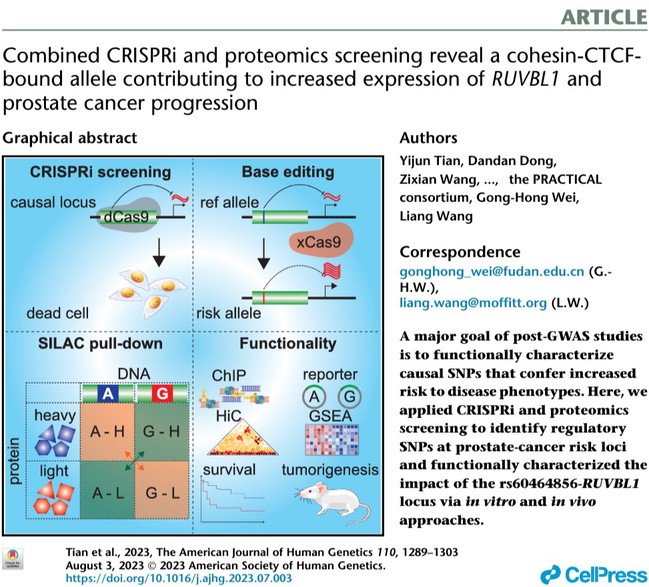
首先,研究人员设计了一个包含9133个gRNA的CRISPRi文库,结果鉴定出可以调节前列腺癌细胞生长优势基因相关的117个SNPs,包括rs60464856。两个独立的大型前列腺癌队列(PRACTICAL和FinnGen)的关联分析结果显示,rs60464856等位基因G均与前列腺癌的风险增加显著相关。此外,eQTL分析显示rs60464856等位基因G与RUVBL1高表达相关联。随后CRISPRi联合xCas9碱基编辑实验证实了rs60464856等位基因G导致RUVBL1表达升高。进一步基于SILAC的蛋白质组学分析结果显示,在 rs60464856 区域存在cohesin-CTCF调控蛋白的等位基因结合,并且基于染色质构象捕捉技术的Hi-C数据发现在前列腺细胞系中存在一致的染色质相互作用。另外,研究人员发现敲低RUVBL1可以抑制异种移植小鼠模型中的前列腺癌细胞的增殖和肿瘤生长。基因集富集分析表明,RUVBL1的表达增加与细胞周期通路的激活以及前列腺癌患者的存活率降低密切相关。
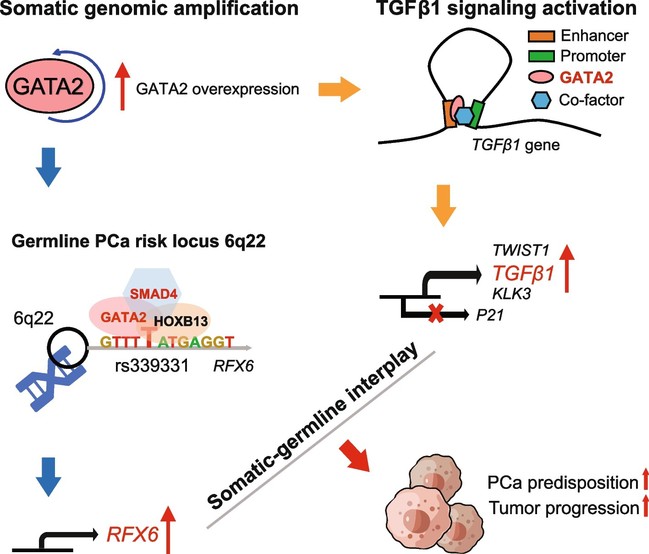
随后,2023年8月8日卫功宏团队与深圳大学吴松团队、奥卢大学Aki Manninen教授联合在Journal of Experimental & Clinical Cancer Research上发表了题为“GATA2 co-opts TGFβ1/SMAD4 oncogenic signaling and inherited variants at 6q22 to modulate prostate cancer progression”的研究。该研究揭示了先锋转录因子GATA2与SMAD4直接相互作用,从而激活TGFβ1/SMAD4致癌信号通路和AR信号通路。另外,GATA2、SMAD4与HOXB13形成转录复合物,结合到风险SNP rs339331的T等位基因,从而增强易感基因RFX6的表达,促进前列腺癌发展。

作者首先分析了大队列前列腺癌全基因组和转录组测序数据,挖掘出58个表达水平与基因组扩增呈正相关的基因。结合全基因组CRISPR/Cas9介导的功能缺失数据,作者发现GATA2与癌细胞增殖密切相关。进一步结合多个临床数据的分析表明,GATA2基因拷贝数扩增和表达水平与病人的临床指征、肿瘤分期、转移、预后差都显著正相关。GATA2基因拷贝数扩增促进其表达水平升高,研究还发现GATA2结合到其附近的一个增强子区域,形成正反馈自我调控。蛋白互作分析发现SMAD4与GATA2直接相互作用,且共调控50%以上相关信号通路与基因,包括激活TGFβ1/SMAD4和AR信号通路。
作者进一步发现,前列腺癌风险SNPs包括rs339331显著富集在GATA2与SMAD4染色质共结合区域。该研究团队前期曾报道转录因子HOXB13能够与rs339331等位基因T结合的机制。本研究则进一步表明,GATA2、SMAD4和HOXB13形成转录调控复合物,共同结合到rs339331-T等位基因上,增强RFX6的表达,进而促进前列腺癌的发展进程。该研究为我们展示了一个异常的体细胞基因组改变和基因过表达是如何影响胚系变异的功能,进而解释了肿瘤易感性和进展的发生机制。该发现还可能为进一步发展前列腺癌的分子标志物和治疗靶点提供依据。
复旦大学基础医学院博士生董丹丹、李姝璇分别为AJHG和JECCR论文的共同第一作者,复旦大学卫功宏教授为两篇论文的通讯作者(含共同)。
AJHG原文链接:https://doi.org/10.1016/j.ajhg.2023.07.003
JECCR原文链接: https://doi.org/10.1186/s13046-023-02745-7






