RNA剪接异常是肿瘤的一个新分子特征,在肿瘤发生、发展与治疗过程中发挥着重要作用,靶向剪接异常的分子疗法已成为一个广泛关注的新方向(1,2)。肺癌是癌症致死的首要原因,具有高度异质性,包括肺腺癌、鳞状细胞癌等多种亚型(3)。KRAS或EGFR激活突变是肺腺癌的主要驱动突变,EGFR突变在东亚人群或非吸烟肺腺癌病人中最高,是靶向治疗的关键的靶点(3,4)。研究表明,与KRAS或EGFR共同出现的抑癌基因突变在肺癌发病机理与治疗中起决定作用(5)。与KRAS突变驱动肺癌相比,这些重要共突变在EGFR驱动肺癌中的研究较少。剪接因子RBM10在肺腺癌中高频率突变,主要引起功能缺失(6,7),在EGFR突变肺腺癌中与抑癌基因TP53突变呈现互斥。然而,RBM10缺失在EGFR突变肺癌中的功能及对治疗的影响尚不清楚。
近日,Cancer Research杂志在线发表了复旦大学基础医学院王勇波组与中国科学院上海营养与健康研究所王泽峰组的合作研究:“RBM10 loss promotes EGFR-driven lung cancer and confers sensitivity to spliceosome inhibition”。该研究揭示了剪接因子异变在肺癌中的促癌功能与机制,促进了对肺癌发病新机理的认识,并为肺癌提供了潜在的治疗新策略。

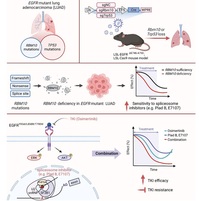
本研究在构建EGFR突变肺癌小鼠模型的基础上,进行了肺特异性Rbm10或Trp53敲除,发现Rbm10缺失促进EGFR突变肺癌的发生发展,与Trp53缺失相似,且Rbm10或Trp53缺失引起共同的基因表达及通路变化,为EGFR突变肺癌中RBM10与TP53突变互斥提供了实验证据。运用RBM10敲低、敲除或缺失的肺腺癌细胞与小鼠模型,揭示RBM10缺失使得肺腺癌细胞对剪接体抑制剂敏感性增强,在RBM10缺失条件下剪接体抑制剂处理引起细胞增殖相关基因特异的剪接变化。进一步发现剪接体抑制剂与EGFR靶向抑制剂联合使用具有协同效应,在RBM10缺失肺腺癌中更为显著,能够有效延缓EGFR靶向制剂耐药的产生,提出了基于剪接体抑制剂与EGFR抑制剂联合使用的肺癌治疗新策略。
复旦大学基础医学院王勇波副教授、中国科学院上海营养与健康研究所王泽峰研究员为本文的共同通讯作者,复旦大学基础医学院博士生包煜芳(已毕业,现为复旦大学基础医学院博士后)、中国科学院上海营养与健康研究所博士生张思蕊(已毕业,现为哈佛医学院布莱根妇女医院博士后)为共同第一作者。本研究受国家自然科学基金、上海市自然科学基金等支持,得到了复旦基础医学院细胞与遗传医学系、复旦大学附属肿瘤医院胸外科团队的大力支持。
原文链接:
https://aacrjournals.org/cancerres/article/doi/10.1158/0008-5472.CAN-22-1549/718411/RBM10-loss-promotes-EGFR-driven-lung-cancer-and
参考文献:
1. Wang Y, Bao Y, Zhang S, Wang Z. Splicing dysregulation in cancer: from mechanistic understanding to a new class of therapeutic targets. Science China Life Sciences 2020;63:469-84
2. Bradley RK, Anczuków O. RNA splicing dysregulation and the hallmarks of cancer. Nature Reviews Cancer 2023;23:135-55
3. Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer. Nature 2018;553:446
4. Cooper AJ, Sequist LV, Lin JJ. Third-generation EGFR and ALK inhibitors: mechanisms of resistance and management. Nature reviews Clinical oncology 2022;19:499-514
5. Skoulidis F, Heymach JV. Co-occurring genomic alterations in non-small-cell lung cancer biology and therapy. Nature Reviews Cancer 2019;19:495-509
6. Zhang S, Bao Y, Shen X, Pan Y, Sun Y, Xiao M, et al. RNA binding motif protein 10 suppresses lung cancer progression by controlling alternative splicing of eukaryotic translation initiation factor 4H. EBioMedicine 2020;61:103067
7. Zhao J, Sun Y, Huang Y, Song F, Huang Z, Bao Y, et al. Functional analysis reveals that RBM10 mutations contribute to lung adenocarcinoma pathogenesis by deregulating splicing. Scientific Reports 2017;7:40488
