肿瘤的生长和扩散依赖于大量的血管生成。血供可为癌细胞提供激素和营养,包括糖份,使用抗血管生成药物可减少肿瘤血管的数量及血糖供应,因此临床上许多种类的抗血管生成药物被用于治疗多种类型的癌症【1】。
然而,抗血管生成药物(antiangiogenic drug,AAD)的临床受益有限。在抗血管生成药物领域有一个长期困扰科学家的问题是:为什么许多药物在小鼠模型上取得了非常好的效果但是一旦在临床上使用起来效果却又很平常【1】,特别是对于乳腺癌、胰腺癌、肝癌和前列腺癌等接近脂肪组织的癌症种类来说,癌症更容易对AAD产生耐药【2】,当然这里面可以有很多种解释,比如说小鼠移植肿瘤主要是在皮下进行移植,而人类肿瘤的发生却很少来源于皮下组织。
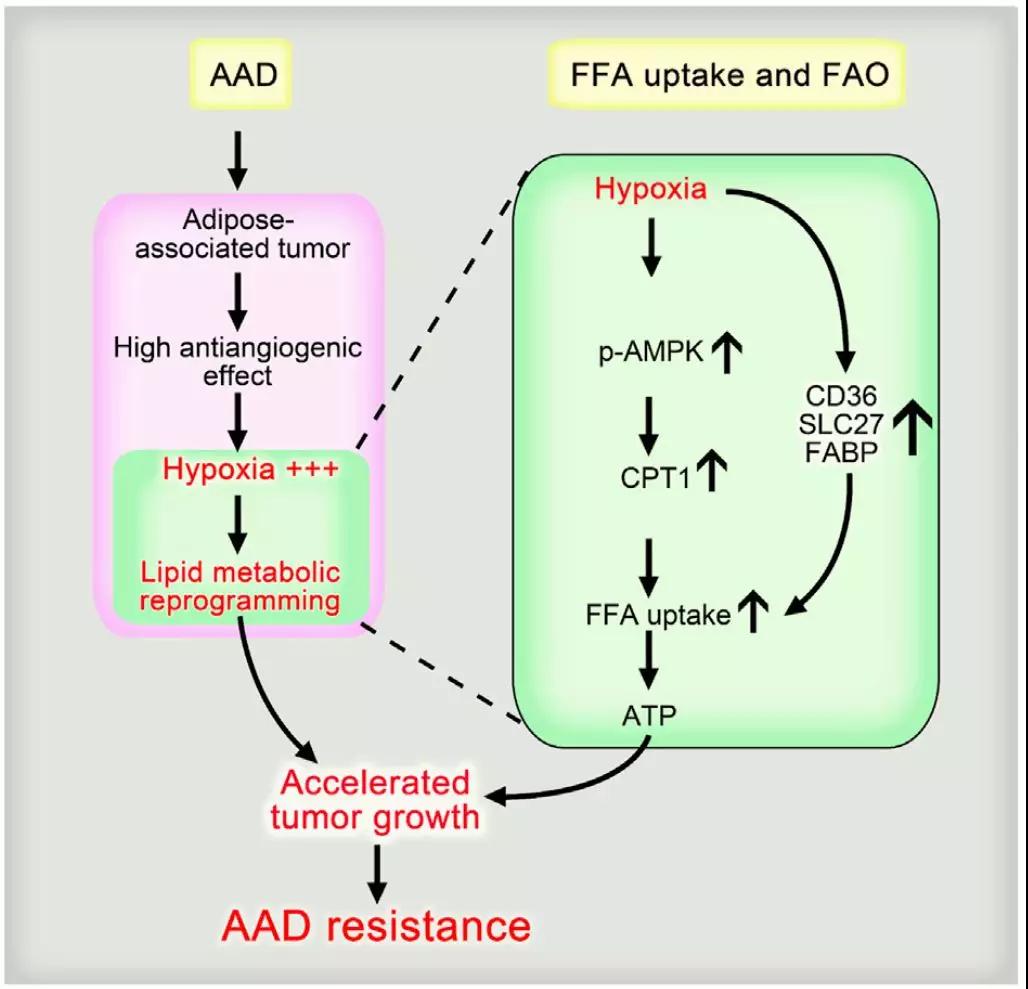
肿瘤血管的减少会导致肿瘤组织缺氧【3】,从而触发肿瘤组织周围或内部的脂肪细胞分解储存的过量脂质,因而脂质能量分子可以在血供不足时用于癌症发展【4】,而这种利用游离脂肪酸用于供应能量的现象常见于非糖酵解依赖的肿瘤中,例如前列腺癌和B细胞淋巴癌【5,6】,最近Nature Genetics上报道的一篇关于前列癌利用脂质作为能量来源的文章大大刷新了人们的认知【5】。正是基于这种机制,使用抗血管生成药物联合阻断脂质能量通路的药物可能有效地治疗癌症。
近日,来自瑞典卡罗林斯卡医学院的肿瘤血管生物学专家曹义海教授等领导的团队(复旦大学基础医学院细胞与遗传医学系青年研究员杨云龙为本文共同第一作者)在Cell Metabolism杂志上发表了题为“Cancer lipid metabolism confers antiangiogenic drug resistance”的研究论文,研究发现脂质分子代谢是肿瘤抗血管生成药物耐药的新机制,阐释癌细胞在血供不足时使用脂质分子替代血糖的作用机理。
在这项研究中,为了弄清楚脂质分子代谢是否参与了肿瘤抗血管生成药物耐药的过程,研究人员首先选取了合适的肿瘤类型——结直肠癌(理由:1、结直肠癌一般生在脂质有关的环境中;2、bevacizumab 是第一款美国FDA批准用于治疗人类结直肠癌的AAD药物;3、结直肠癌患者对AAD有很强的耐药性)。研究结果显示,在非脂肪环境下,AAD药物能够显著抑制肿瘤生长(74%),而在有脂肪的环境下,AAD药物对结直肠癌的生长抑制只有21%(研究人员在胰腺胆管癌和脂肪肝肿瘤模型中也到了类似的结果)。
在分子机理层面上,研究人员运用全基因组基因表达分析发现,在使用AAD药物处理肿瘤后发现有许多脂肪酸氧化以及游离脂肪酸相关基因的表达发生了显著变化。这表明,在有脂肪环境下生长的肿瘤在使用AAD药物处理后发生了脂质代谢的重编程,更进一步研究发现AAD药物处理后的肿瘤中其AMPK的磷酸化水平发生了变化(激活),而这种变化是由于hypoxia(缺氧)造成的(下图)。此外,研究人员还从脂肪酸氧化限速酶CPT1入手,发现了当敲低脂肪酸氧化限速酶CPT1时,在有脂肪环境下的肝硬化肿瘤中使用AAD药物时,其耐药性被逆转了。
既然敲低CPT1的量能够逆转AAD药物的耐药性,那么如果联合使用CPT1抑制剂(从头筛选到)和AAD药物的情况下对于脂肪环境下生长的肿瘤具有良好的抑制效果是显而易见的,小鼠模型也证明了这一点。
总的来说,该研究从临床上抗血管生成药物的耐药性出发,有效地证明了脂质能量通路对AAD药物耐药性的影响,并阐明了癌细胞在血供不足时使用脂质分子替代血糖的作用机理,最后通过小鼠模型还证明了使用抗血管生成药物联合阻断脂质能量通路的药物可能有效地治疗癌症。
然而正如文章最后所指出的那样,目前缺乏的是,上述效果还没有在临床上进行试验。未来研究者们将进一步研究这一联合疗法是否会改善人类癌症患者的生活质量和寿命。
据了解,瑞典卡罗林斯卡医学院的曹义海教授是本研究的Lead Contact,深圳大学一附院Guohui Nie和上海中医药大学Qi Li为本文共同通讯作者。日本Kurume大学Hideki Iwamoto博士和日本Kurume大学Mitsuhiko Abe博士以及复旦大学基础医学院青年研究员杨云龙是本文的共同第一作者。 参考文献: 1.Cao, Y., Arbiser, J., D’Amato, R. J., D’Amore, P. A., Ingber, D. E., Kerbel, R., ... & Dvorak, H. (2011). Forty-year journey of angiogenesis translational research. Science translational medicine, 3(114), 114rv3-114rv3. 2.Bergers, G., & Hanahan, D. (2008). Modes of resistance to anti-angiogenic therapy. Nature Reviews Cancer, 8(8), 592. 3.Rapisarda, A., & Melillo, G. (2012). Role of the VEGF/VEGFR axis in cancer biology and therapy. In Advances in cancer research (Vol. 114, pp. 237-267). Academic Press. 4、Beloribi-Djefaflia, S., Vasseur, S., & Guillaumond, F. (2016). Lipid metabolic reprogramming in cancer cells. Oncogenesis, 5(1), e189. 5.Chen, J., Guccini, I., Di Mitri, D., Brina, D., Revandkar, A., Sarti, M., ... & Civenni, G. (2018). Compartmentalized activities of the pyruvate dehydrogenase complex sustain lipogenesis in prostate cancer. Nature genetics, 1. 6.Caro, P., Kishan, A. U., Norberg, E., Stanley, I. A., Chapuy, B., Ficarro, S. B., ... & Zhou, F. (2012). Metabolic signatures uncover distinct targets in molecular subsets of diffuse large B cell lymphoma.Cancer cell, 22(4), 547-560. |