
近日,复旦大学陆路/姜世勃研究团队与上海科技大学杨贝/Wilson研究团队通力合作,通过交叉运用多种不同的技术手段,研发了能够广谱抑制多种人冠状病毒(HCoV)感染的多肽类融合抑制剂EK1,并揭示了其作用靶点和发挥功能的分子机制。该研究同时证明了冠状病毒(CoV)刺突蛋白的HR1区域是一个重要且保守的药物作用靶点,为后续抗HCoVs的广谱药物研发提供了理论基础和重要思路。4月10日,该研究成果以“A pan-coronavirus fusion inhibitor targeting the HR1 domain of human coronavirus spike”为题在线发表于Science子刊《科学进展》(Science Advances)上。
近年来,严重急性呼吸综合征冠状病毒(Severe acute respiratory syndrome coronavirus, SARS-CoV)和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)等高致病性HCoVs的出现对人类的生命健康及社会的稳定发展带来了威胁,但目前临床上尚无获得批准的特异性抗SARS-CoV和MERS-CoV感染的药物。更为重要的是,自然界中广泛存在的其他CoVs也可能通过跨种传播感染人类。近期,世界卫生组织(WHO)提出要防御“Disease X”, 即由目前未知的病原体(包括新型冠状病毒)引起的严重国际大流行的人类疾病(http://www.who.int/blueprint/priority-diseases/en/)。因此,探寻在各种HCoVs上均保守的药物靶点,以及基于这些靶点研发广谱、高效的抗HCoVs药物成为本领域亟待解决的关键科学问题。该类研究也将为目前流行的HCoVs的防治和未来可能出现的新型HCoVs的防控提供解决方案和技术储备。
复旦大学研究团队在2014年发表于《自然通讯》(Lu L et al., Nature Communications 5:3067, 2014)的前期相关工作中成功研发了靶向于MERS-CoVS蛋白上HR1区域的多肽类融合抑制剂MERS-HR2P,其可有效阻止MERS-CoV的感染过程。然而,尽管MERS-CoV和SARS-CoV同属β类HCoVs,MERS-HR2P却并不能有效抑制SARS-CoV的感染;同样,针对于SARS-CoV HR1的多肽也无法有效地抑制MERS-CoV感染。此外,上海科技大学研究团队的前期已发表工作也揭示,α-HCoVs与β-HCoVs的HR1s区域展示出不同的长度,并具有不同的表面电荷分布特征(Yan L et al., Acta Crystallogr D Struct Biol. 74:841-51, 2018),这一现象进一步增加了不同HCoVs间HR1s区域的差异。因此,这些HR1s靶点是否具有足够的保守性以支撑广谱抗HCoV融合抑制剂的研发在领域内一直存在争议。
为解决该关键科学问题,联合研究团队建立了多个可模拟HCoVs感染过程的“细胞-细胞膜融合”系统,并通过交叉筛选的方式,发现一条具有广谱抗HCoV活性的多肽:OC43-HR2P。在此基础上,团队成员进一步优化序列,从而获得一条溶解度更好、抑制活性更高的多肽EK1。多肽EK1在α-HCoVs和β-HCoVs的假病毒和活病毒感染系统上均展示出广谱且高效的抗病毒活性(如Figure 1所示)。
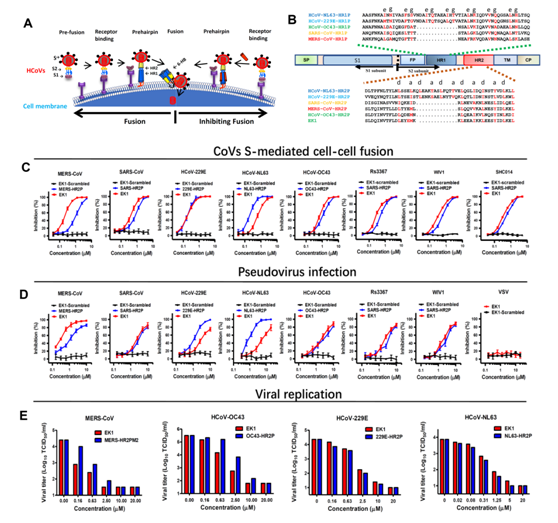
Figure 1. The potent and broad-spectrum antiviral activity of EK1. A. The antiviral mechanism of HR2P peptides. B. The sequences of the designed peptides: HR1Ps, HR2Ps and EK1. C. Inhibitory activity of EK1 in cell-cell fusion mediated by the various CoV S proteins. D. Inhibitory activity of EK1 against pseudotypedCoVs infection. E. Inhibitory activity of EK1 on live HCoV replication for MERS-CoV, HCoV-OC43, HCoV-229E and HCoV-NL63, respectively.
联合研究团队进一步解析了多肽EK1与分别来源于α和β类等多个不同HCoVs的HR1s的共晶结构。研究结果显示EK1可通过大量保守而又广泛的疏水及亲水相互作用与不同HCoVs的HR1s区域结合(如Figure 2所示)。研究还发现多肽EK1在与不同长度、不同理化特征的HR1s发生相互作用时具有很好的构象可塑性与表面电荷包容性,从而保障其可广谱地作用于α-HCoVs和β-HCoVs的HR1s区域。这些结果不仅从结构上揭示了多肽EK1广谱、高效抑制不同HCoVs感染的分子机制,同时也证明了HR1s在功能和结构上具有独特的保守性,可成为研发广谱抗HCoVs药物的重要靶点。
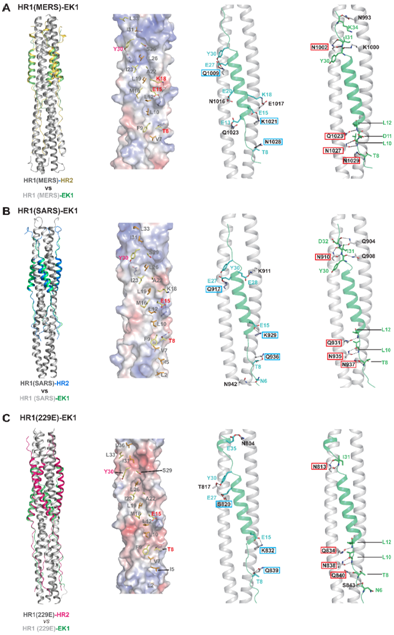
Figure 2. Structural Studies of EK1 in complex with the HR1 regions from MERS-CoV (A), SARS-CoV (B) and 229E (C) unravel the molecular basis for the pan-CoVinhibitory effect of EK1 peptide.1st panel: Structural comparison of the HR1-EK1 6-HB bundles and cognate HR1-HR2 6-HB bundles reveals that the EK1 peptide binds to the 3HR1 core of different HCoVs in a similar manner to that of thenative HR2 of corresponding HCoV. 2nd-4th panel: the extensive and highly-conserved hydrophobic and hydrophilic interactions between EK1 and different HR1s; EK1 residues that are involved in hydrophobic packing are shown as stick models on the electrostatic surfaces of 3HR1 cores(2nd panel), and HR1 residues from MERS-CoV, SARS-CoV and 229E that meditate highly conserved side chain–to-side chain (3rd panel) and side chain-to-main chain (4th panel) hydrophilic interactions with EK1 residues are boxed in cyan and red respectively.
在上述研究的基础上,联合研究团队进一步开展了多肽EK1在动物体内抗病毒活性的研究。结果显示EK1在代表性病毒HCoV-OC43和MERS-CoV感染的小鼠模型上均展示出较好的体内抗病毒效果,并且该多肽在体内具有较好的安全性和和较低的免疫原性,提示其具有良好的应用前景,有被进一步开发成为用于防治目前流行的多种HCoVs和应对未来可能出现的新型HCoVs的特异性药物的潜力。
复旦大学博士后夏帅、徐巍和上海科技大学博士研究生严磊为本文的共同第一作者,复旦大学陆路研究员和姜世勃教授、上海科技大学免疫化学研究所Co-PI杨贝和Ian A.Wilson教授为本文的共同通讯作者。本研究在复旦大学与上海科技大学等兄弟院校的通力合作下完成,并得到了中国疾控预防控制中心谭文杰教授、美国德克萨斯大学医学部Chien-TeK. Tseng教授等学者的大力支持与帮助;受到了来自于国家十三五传染病重大专项、国家自然科学基金面上项目等基金的资助。
责任编辑:刘晔瀚





