孟丹教授团队揭示人胚胎干细胞自我更新和分化的新机制
近日,复旦大学基础医学院孟丹研究组与复旦大学附属中山医院张书宁副主任医师合作揭示了人胚胎干细胞自我更新和分化的新机制。3月13日,研究成果以《Bach1调控人胚胎干细胞自我更新并抑制干细胞向中胚层和内胚层的分化》(“Bach1 Regulates Self-renewal and Impedes Mesendodermal Differentiation of Human Embryonic Stem Cells”)为题在线发表于《科学进展》(Science Advances)。该研究首次揭示了一种关键的转录因子Bach1(BTB and CNC homology 1)在调控人胚胎干细胞自我更新和分化中的重要作用及作用机制。研究结果对理解干细胞维持自身特性、胚胎发育早期阶段中胚层和内胚胎的形成过程具有重要启示,可能为开发干细胞治疗人类疾病的新疗法提供新思路。
干细胞具有自我更新和多能性,在一定条件下可以分化为体内任何种类的细胞。因此,干细胞在器官再生和细胞替代治疗中具有广阔的应用前景。尽管近些年来科学家们在理解并指导干细胞分化领域的研究上取得了一定的成绩,但调控胚胎早期中胚层和中胚层衍生物(包括心血管系统等)的分子机制还有很多问题尚不清楚,妨碍了将其分化的细胞安全有效地应用于临床。因此,研究干细胞如何维持多能性,如何向中胚层分化是亟需解决的科学问题,对人类疾病的再生医学治疗具有重大的意义。
研究团队前期在《循环研究》(Circulation Research)上发表的研究中,筛选发现了一个新的调控血管新生的上游关键转录因子Bach1,证实了Bach1抑制缺血性心血管疾病血管新生的新作用和新机制。Bach1基因全身缺失可引起小鼠亚致死,但在人胚胎干细胞中Bach1蛋白的表达和功能不清楚;随后研究人员开展了Bach1在干细胞功能和分化中的一系列研究。研究发现Bach1可促进人成体细胞的重编程,促进人表皮细胞“返老还童”,变成诱导性多能干细胞。Bach1在小鼠胚胎发育早期高表达,与多能性因子Oct4共同表达在胚胎的内细胞团。Bach1在维持人胚胎干细胞自我更新中发挥着重要的作用,Bach1蛋白可以和多能性因子Nanog, Sox2和Oct4相互作用,并通过招募去泛素化酶USP7维持多能性因子的蛋白质稳定性。Bach1在由人胚胎干细胞衍生的中胚层和内胚层的形成过程中扮演着非常重要的角色。在人胚胎干细胞中敲除Bach1基因可促进干细胞向中胚层和内胚层分化,促进心血管前体细胞的分化。
研究人员还首次证实了Bach1蛋白在组蛋白甲基化修饰方面发挥着独特的作用,是新的表观遗传调控因子。Bach1是多梳蛋白抑制性复合体2(PRC2复合体)的一个新成员,调控组蛋白赖氨酸三甲基化(H3K27me3)的修饰,抑制中胚层和内胚层分化基因的转录。此外,Bach1还抑制Wnt/β-catenin 和Nodal/Smad2/3 信号通路,抑制人胚胎干细胞向中胚层和内胚层的分化。这项研究表明Bach1是干细胞维持自我更新和决定谱系分化中的关键调控因子,Bach1在中胚层和心血管早期分化过程中起重要作用,Bach1有可能成为干细胞治疗心血管疾病的新靶标,因此这项研究结果对于再生医学领域的相关研究具有重要的科学意义。
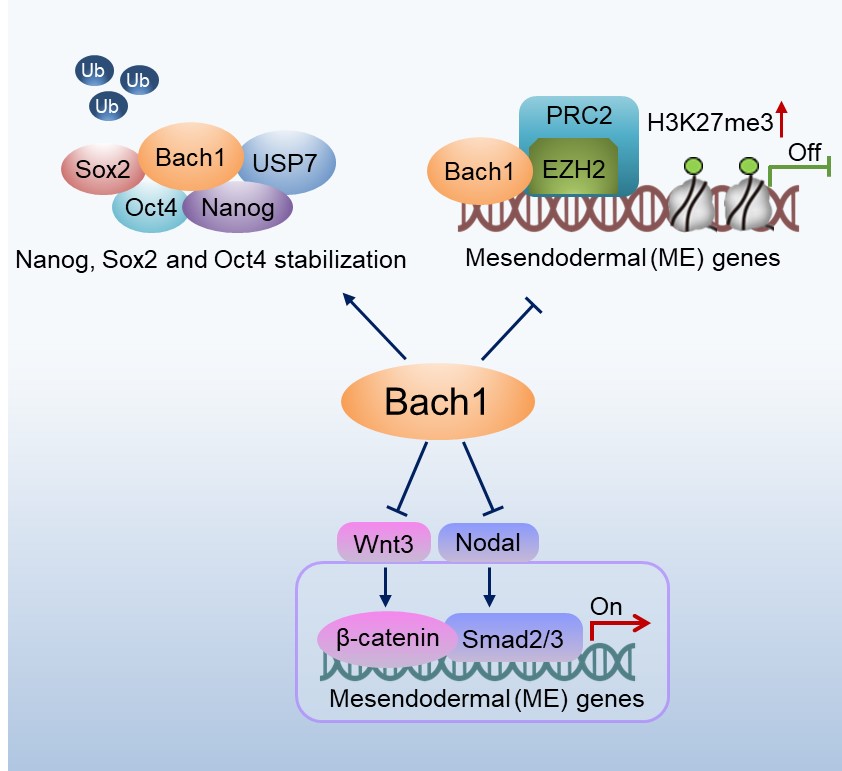
Bach1维持人胚胎干细胞自我更新并抑制干细胞向中胚层和内胚层分化的机制图

