
肝移植是终末期肝病及原发性肝癌的治愈手段,因供肝来源的高度匮乏,活体肝移植成为常用的肝移植手段。能否再生到原有肝大小是衡量活体肝移植是否成功、供体和受体生活质量的重要指标。因此,研究调控肝脏再生的信号通路及其相关分子,对预测供肝的再生能力、开发新治疗手段以促进移植肝再生或减少受者术后并发症具有重要意义。近期,复旦大学基础医学院医学分子病毒学教育部/卫健委/医科院重点实验室暨病原生物学系吴健教授课题组与复旦大学生物医学研究院暨附属儿科医院余发星研究员团队合作,在Clinical and Translational Medicine期刊在线发表题为“JCAD Deficiency Delayed Liver Regenerative Repair through the Hippo-YAP Signaling Pathway”的研究论文,揭示了JCAD在部分肝切除(PH)后肝再生过程中的重要作用。

冠状动脉疾病相关连接蛋白(JCAD)是一细胞连接蛋白,参与基于E-钙粘蛋白上皮细胞间紧密连接的形成,在种系进化中高度保守,在动脉粥样硬化、冠心病、及血栓形成等病理过程中发挥重要作用。该课题组前期发现代谢障碍脂肪性肝炎相关肝癌(MASH-HCC)标本及多种肝癌细胞系高表达JCAD,后者通过降低大肿瘤抑制激酶(LATS)2的磷酸激酶活性,促进细胞增殖并参与肿瘤形成过程(Cancer Res 2017)。本研究采用肝大部切除术(PH)模拟部分肝切除或小肝移植术后肝脏再生修复过程。鉴于JCAD蛋白水平动态增加与PH后肝再生峰值相一致,JCAD被认为是参与肝脏再生过程的关键正向调控因子。该研究使用了JCAD全身敲除鼠(JCAD-KO)和肝特异性敲除鼠(Jcad△Hep)探究JCAD在肝脏再生过程中的作用。全身和肝脏特异性JCAD缺失都导致了PH后的肝脏再生阻滞,表现为细胞周期相关基因的表达减少和DNA复制受损。经活细胞可视化手段证实JCAD缺失会导致细胞周期转换受阻、细胞周期延长。与此相反,从JCAD-KO 鼠分离的原代肝细胞中回补JCAD 可逆转这一现象,而添加YAP抑制剂维替泊芬(VP)则可抵消回补JCAD所引起的细胞增殖反应。这些数据证实JCAD借用Hippo-YAP信号轴介导细胞周期转换促进肝再生。
该研究深入探讨了JCAD作用的分子机制。研究表明JCAD可通过“PPxY-WW”结构域与LATS竞争性结合WWC1支架蛋白,抑制LATS磷酸化信号传递,导致转录因子YAP的磷酸化水平降低,YAP入核增加,激活下游与细胞周期转换相关的靶基因表达,促进细胞增殖(如下图所示)。
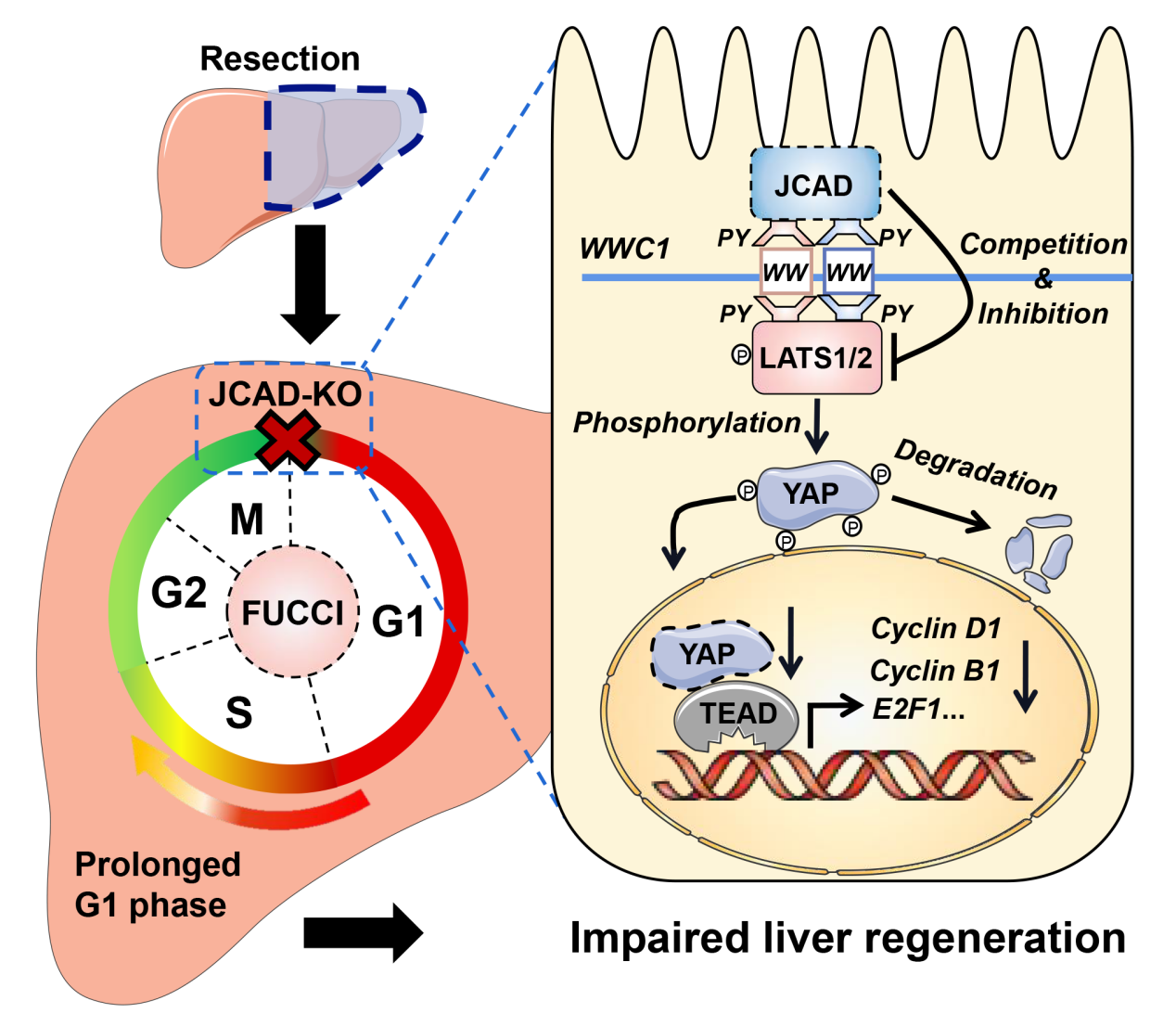
JCAD经Hippo-YAP信号通路介导细胞周期依赖方式促进肝脏再生
综上所述,该研究发现JCAD缺失以Hippo-YAP信号通路依赖的方式导致细胞周期阻滞,从而引起部分肝切除术后肝脏再生延迟。深入揭示JCAD-Hippo-YAP信号通路在肝脏再生过程中的调控作用将有助于精确制定急性肝衰竭治疗方案、改善活体肝移植患者的预后。
该论文通讯作者为复旦大学基础医学院医学分子病毒学教育部/卫健委/医科院重点实验室暨病原生物学系教授、附属中山医院消化科双聘教授/上海市肝病研究所脂肪肝及代谢性疾病研究实验室主任吴健医学博士,复旦大学生物医学研究院暨附属儿科医院余发星研究员为共同通讯作者。复旦大学基础医学院病原生物学系博士生张荔、杨咏玉和谢黎为共同第一作者。该研究项目得到自然科学基金等机构的资助。
原文连接:https://onlinelibrary.wiley.com/doi/10.1002/ctm2.1630





