
多发性硬化症(Multiple Sclerosis, MS)是一种以中枢神经系统(CNS)慢性炎症性脱髓鞘为特征的自身免疫性疾病,主要影响大脑、脊髓和视神经等关键神经结构。尽管现有的免疫调节和疾病修饰治疗(DMTs)能够在一定程度上控制疾病活动并延缓进展,但依然无法实现治愈,且可能伴随严重的副作用。因此,深入探讨MS的分子机制并探寻新的治疗靶点具有重要的临床价值。近年来的研究表明,神经炎症是MS的核心病理特征。在这一过程中,细胞焦亡(Pyroptosis)作为由Gasdermin蛋白家族(GSDMs)介导的程序性细胞死亡方式,已被证实在多种炎症性疾病中发挥重要作用。Gasdermin E(GSDME)作为GSDM家族的重要成员,其在神经炎症和神经退行性疾病中的潜在作用正日益受到关注。然而,GSDME在MS中的具体作用机制及其调控网络尚不明确。
2025年6月25日,复旦大学基础医学院汪军课题组联合附属中山医院陈万坤课题组、海军军医大学曹莉课题组,在Cell Death and Differentiation期刊上发表了题为“GSDME-mediated pyroptosis in microglia exacerbates demyelination and neuroinflammation in multiple sclerosis: Insights from humans and cuprizone-induced demyelination model mice”的研究性文章。该研究阐明了GSDME介导的小胶质细胞焦亡在MS脱髓鞘和神经炎症中的核心作用,为脱髓鞘和神经炎症性疾病提供了新的治疗靶点。

研究发现,MS患者的CNS病变区域中,GSDME蛋白表达显著升高,特别是在损伤部位的小胶质细胞中,观察到明显的GSDME蛋白剪切。为进一步探讨其机制,研究团队使用铜腙(CPZ)诱导的脱髓鞘小鼠模型,发现Gsdme基因敲除显著改善CPZ引起的运动功能障碍、脱髓鞘和神经炎症反应。此外,caspase-3抑制剂有效抑制GSDME的激活,减轻脱髓鞘程度、改善运动协调和缓解神经炎症。在实验性自身免疫性脑脊髓炎(EAE)模型中,caspase-3/GSDME信号通路通过介导小胶质细胞焦亡在神经炎症和白质脱髓鞘中发挥关键作用。转录组分析显示,GSDME不仅调控疾病相关小胶质细胞(DAMs)的特定基因表达,还抑制小胶质细胞自噬,这一过程对髓鞘碎片的清除至关重要(图1)。本研究揭示了GSDME介导的细胞焦亡在MS发病机制中的关键作用,通过靶向调控GSDME介导的小胶质细胞焦亡和自噬功能,可能为MS及其他神经炎症性疾病提供新的治疗靶点。该发现不仅深化了对神经退行性疾病分子机制的理解,也为基于GSDME的治疗策略奠定了理论基础,具有重要的临床应用潜力。
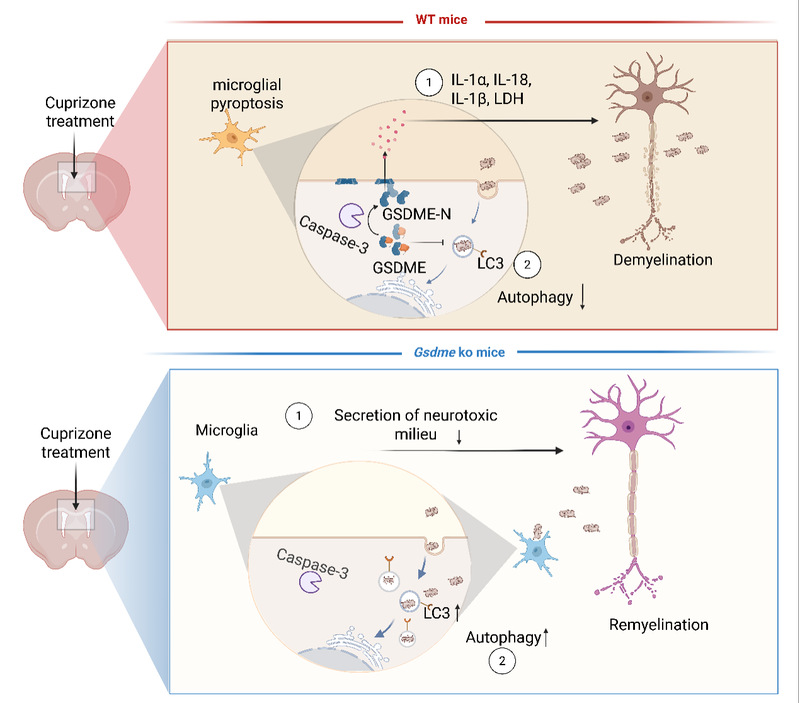
图1 GSDME在多发性硬化症脱髓鞘损伤中的作用机制
复旦大学基础医学院汪军、复旦大学附属中山医院陈万坤、海军军医大学曹莉为本文的共同通讯作者,复旦大学基础医学院的王丹杰(已毕业)、张童童(已毕业)及海军军医大学的邵麒为共同第一作者。本研究受到国家自然科学基金、上海市地高建项目等资助,并得到了复旦大学基础医学院大型仪器共享平台的大力支持。
原文链接: https://doi.org/10.1038/s41418-025-01537-0





