我校教育部卫生部医学分子病毒重点室引进人才蔡启良研究员于2012年全职回国后,迅速组建了微环境肿瘤病毒学课题组,并在解密疱疹病毒如何持续性感染和颠覆正常细胞诱发癌症生成机制方面取得了两项重要突破。关于此研究结果介绍的两篇论文令人兴奋地被国际权威杂志《PLoS病原体》同期接受并发表。至此,蔡启良研究员在该杂志上发表文章的总数已达10篇。
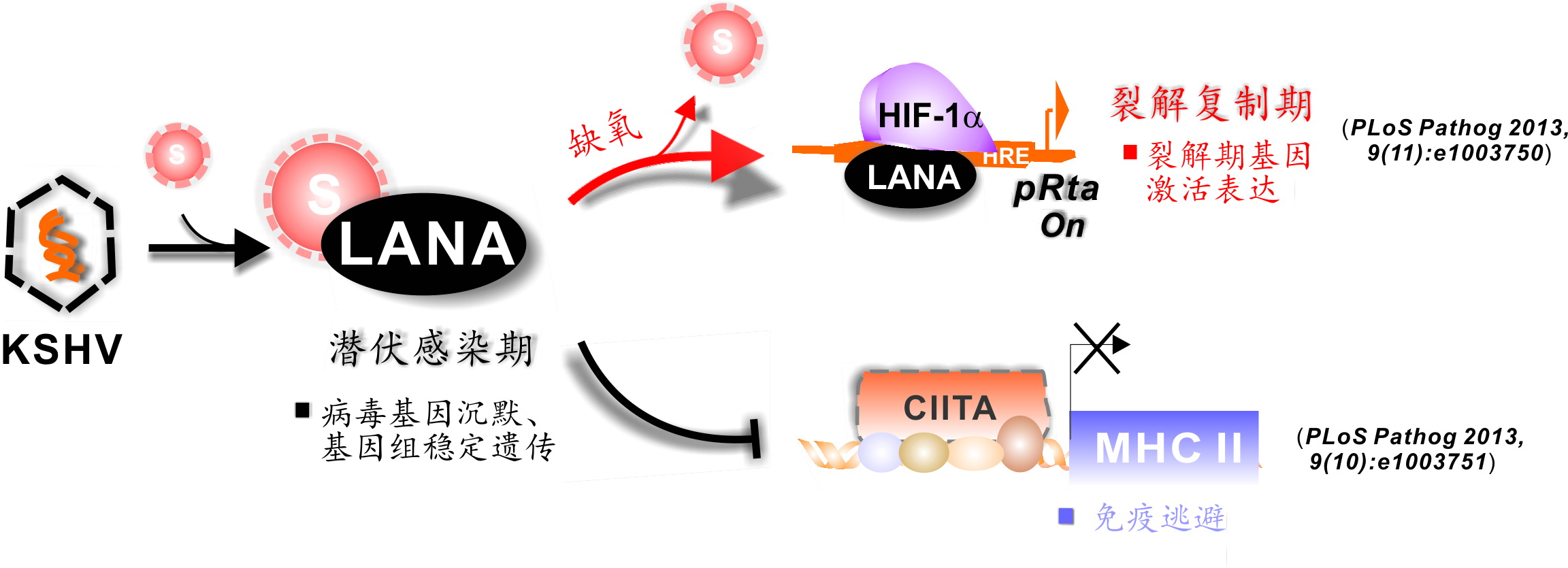
肿瘤病毒如何维护自身持续性感染?与宿主细胞癌变后免疫逃逸的关系如何?一直是肿瘤病毒学领域的研究热点。卡波氏肉瘤病毒(简称KSHV)是一种常见于艾滋病和器官移植患者以及免疫力低下老年人的肿瘤病毒。蔡启良研究员课题组率先发现了在持续性感染过程中KSHV编码的一种潜伏期关键毒抗原¾ LANA是通过被一种具有分子开关功能的因子SUMO2修饰,完成对KSHV病毒维持潜伏感染状态的调节。这种修饰不仅能精确地调控毒蛋白的表达,而且对保持病毒附加体基因组的持续稳定传代起着关键性作用。不同供氧条件下LANA功能不同。在缺氧(临床上患者肢体末梢肿瘤组织常处于缺氧状态)条件下,SUMO2开关可将LANA切换到激活状态,活化后的LANA可与主要缺氧应答因子HIF1a紧密相互作用,并激活病毒自身裂解复制基因的大量表达。相反地,在正常氧条件下的HIF1a被LANA介导SUMO2修饰,并通过招募共抑制复合物阻止其它大部分病毒基因的表达,从而阻止病毒自身裂解复制而维持潜伏感染(PLoS Pathog 2013, 9(11): e1003750)。另一项成果则发现LANA可大大降低宿主细胞表面蛋白的表达,同时减少宿主细胞和其它免疫杀伤细胞之间的通信。LANA不仅调控主要组织复合物MHCII转录激活因子CIITA的转录,而且直接降低靶细胞的MHCII抗原递呈能力,以达到免疫逃逸的目的,从而维护了病毒的持续性感染(PLoS Pathog 2013, 9(10): e1003751)。
这两项研究表明该肿瘤病毒具有在低氧气条件下调节免疫反应,以及重新激活病毒基因的功能;提示翻译后SUMO2修饰介导的病毒侵染机制对KSHV 自身持续性感染以及帮助癌变细胞免疫逃逸起着关键性作用。该研究成果是否可以延伸至其他肿瘤病毒(如HBV和HPV等)致瘤机制有待进一步研究。(参与本研究还有美国宾夕法尼亚大学医学院Erle Robertson教授和英国伯明翰大学Andrew Hislop教授的课题组)