
目前肝细胞癌(HCC)的精准治疗依然是一个难题,临床上获批用于晚期肝细胞癌患者的靶向治疗药物,包括索拉非尼、仑伐替尼,及免疫检查点抑制剂等,尽管展现出一定的治疗效果,但由于肝肿瘤微环境的异质性,常常导致原发性或获得性耐药,使接受治疗患者的总生存期改善不如预期。

近日,复旦大学基础医学院梁春敏团队联合复旦大学附属中山医院邱双健主任、施杰毅主治医生在Signal Transduction and Targeted Therapy 期刊在线发表了题为“Differential expression pattern of CC chemokine receptor 7 guides precision treatment of hepatocellular carcinoma”的研究成果。该研究揭示了趋化因子受体CCR7在免疫细胞和原发性肝癌细胞中的不同表达,及其呈现出的截然不同的生物学效应,研究发现对原发性肝癌的精准治疗具有指导意义。
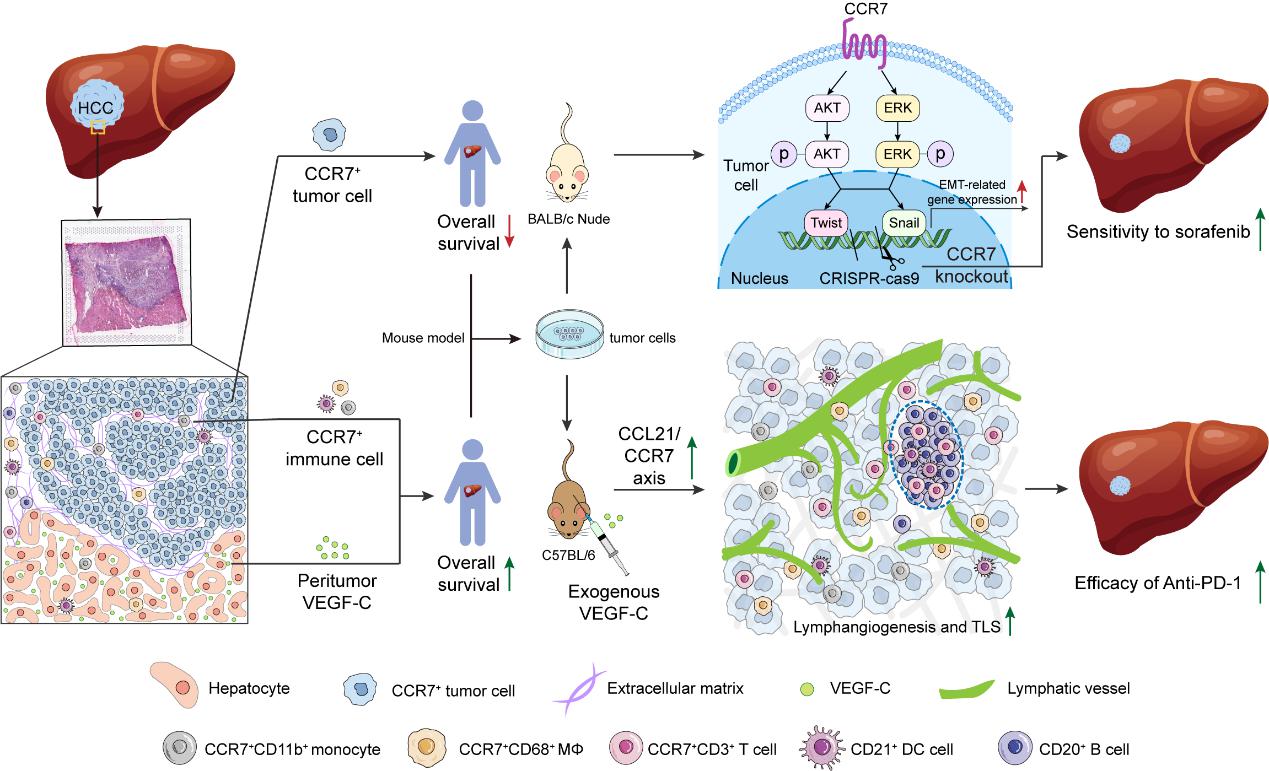
趋化因子受体CCR7是一种典型的G蛋白偶联七次跨膜蛋白,在生理状态下,CCR7主要表达于各类免疫细胞上,接受其配体趋化因子CCL21和CCL19在体内的”排兵布阵”作用,调控免疫细胞在体内的定向迁移和分布。但同时当体内肿瘤发生时,CCR7也会在不同的肿瘤细胞膜上表达,影响肿瘤细胞的生物学行为,从而增加了肿瘤免疫微环境的复杂性。
本研究通过组织芯片、空间转录组和单细胞测序以及原位肝细胞癌动物模型等研究手段,发现CCR7在临床肝细胞癌患者中存在不同的表达模式,尤其是在肝癌细胞和肿瘤间质区域。一方面,肝癌细胞若高表达CCR7,预示患者总生存期较短;利用CRISPR-cas9系统敲除肿瘤细胞的CCR7,可通过AKT/ERK信号通路抑制肿瘤细胞的上皮间充质转化,进而增强肿瘤细胞对药物索拉非尼的敏感性。另一方面,研究发现肿瘤间质区域也有较多CCR7+免疫细胞(如CD4+ T细胞、naïve B细胞、树突状细胞和巨噬细胞等)浸润。而且,CCL21和VEGF-C的高表达,与CCR7+免疫细胞的瘤内浸润显著相关。进一步通过临床前研究的小鼠原位肝细胞癌动物模型,证明了外源性VEGF-C能够通过激活淋巴管新生和CCL21/CCR7信号轴,促进三级淋巴结构的形成,提高PD-1单抗免疫疗法的治疗效果。表达在肿瘤细胞上的CCR7如黑天鹅,表达在免疫细胞上的CCR7如白天鹅,合理的靶向调控可以实现黑天鹅的向善而生。
该研究发现不仅为免疫检查点治疗药物的精准选择提供了新的策略,而且也使由于耐药性的产生降为临床二线的靶向药物(如索拉菲尼)重新回到一线治疗药物成为可能,并为所有内胚层起源实体肿瘤的治疗提供了一个泛癌作用靶点。

复旦大学基础医学院解剖与组织胚胎学系梁春敏教授、中山医院肝胆肿瘤与肝移植外科邱双健主任和施杰毅主治医生为该论文的共同通讯作者,基础医学院解剖与组织胚胎学系秦杰副教授、博士研究生龚倩怡和中山医院周成、许接天博士后以及成怡斐博士研究生为该论文的共同第一作者。
感谢本项目的主体工作得到3个国家自然科学基金项目(项目编号:31971111、U24A20729、31471147)的跨越十年的接力支持,感谢基础医学院王作云青年研究员、李倩青年研究员和中山医院肝癌研究所刘彬彬副研究员、高强教授的大力支持,特别感谢中国人民解放军海军军医大学陈磊研究员、南通大学刘东研究员和加州大学洛杉矶分校朱亚珍研究员对本研究工作的帮助。





