
近日,复旦大学基础医学院生化与分子生物学系施冬云课题组,设计了一种新型肝靶向脂质体药物Nano-MitoPBN,可通过对糖尿病动物靶向到达其肝脏线粒体,实施精准干预肝脏微区的氧化还原状态,使得异常的葡萄糖代谢恢复正常,从而降低肝葡萄糖和血糖水平、实现有效控制和治疗糖尿病。这方面的研究成果,於8月26日,以《肝靶向Nano-MitoPBN通过改善线粒体氧化还原平衡使得葡萄糖代谢正常化》(Liver-targeted Nano-MitoPBN normalizes glucose metabolism by improving mitochondrial redox balance)为题,在线发表于国际权威杂志《生物材料》(Biomaterials)。全文链接:https://doi.org/10.1016/j.biomaterials.2019.119457

氧化还原失衡已证明是许多疾病发生的源头。2型糖尿病的特征是体内糖代谢异常,呈高血糖,其源头与肝脏微区的氧化还原失衡有关。施冬云课题组先前的研究发现ROS可以重新编程肝脏中的葡萄糖代谢,从而诱导2型糖尿病大鼠胰岛素抵抗[1]。并且发现上调抗氧化酶GRX可以改善肝脏葡萄糖代谢,缓解高血糖[2]。这意味着体内氧化还原状态与维持正常葡萄糖代谢和正常血糖密切相关。肝脏是产生葡萄糖的主要器官,因此以肝脏为靶器官,通过精准干预肝脏中的氧化还原失衡状态,可能是未来治疗胰岛素抵抗和防治2型糖尿病的一种新的有效途径和诊疗策略[3]。文章通过精准干预肝脏微区的氧化应激水平从而实现降低血糖水平,之前尚未见有类似的研究报道,具有开创性。
脂质体是当前临床应用最为广泛的一类纳米药物载体,但是临床转化存在瓶颈,因为大部分纳米脂质体颗粒被肝脏截留导致不能有效利用,但肝脏也是纳米脂质体的完美靶标。施冬云课题组所研制出脂质体包裹的靶向肝线粒体的Nano-MitoPBN,由于可微区室化,可进入线粒体清除由肝脏线粒体电子传递链(ETC)的单电子泄漏所产生的超氧化物/过氧化氢,从而调节和维持线粒体的氧化还原动态平衡,增加线粒体态3(mitochondrial state 3)的呼吸速率,呼吸控制比(RCR),从而降低NADH/NAD+的比值,增加ATP的合成,促进线粒体功能。此外,Nano-MitoPBN通过减少肝脏ROS,改善氧化还原状态,逆转了糖尿病动物中过剩ROS所介导的肝脏糖代谢重编,提高了糖酵解和肝脏有氧氧化,从而有效地降低了糖尿病动物的外周血糖水平并恢复了糖尿病动物的葡萄糖耐受能力。这也为微区化纳米药物研发提供了新的亮点。该糖尿病治疗策略克服了传统抗氧化剂生物利用率低的瓶颈,显示很好的临床转化前景。
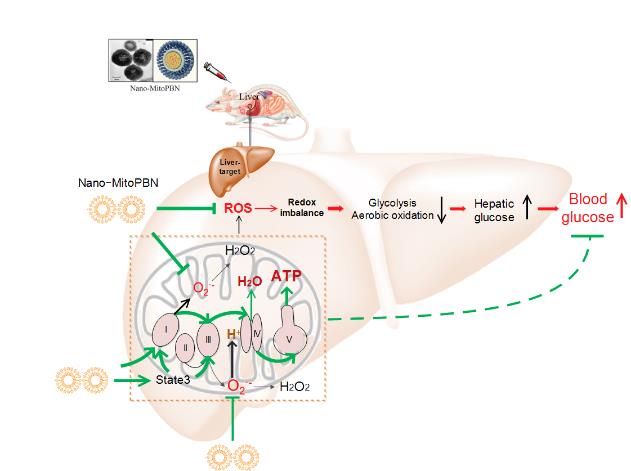
施冬云课题组的研究成果也突破了传统糖尿病药物设计思路,利用脂质体的肝靶向性,将含阳离子基团的抗氧化纳米药物导入肝脏线粒体,通过精准干预肝脏微区的氧化还原失衡状态,从而恢复异常的肝线粒体生物能量学和肝葡萄糖代谢,最终改善并治疗糖尿病。该研究成果不但为开发新型的肝靶向抗糖尿病药物提供新思路,也为临床氧化还原精准干预策略提供了理论基础。
基础医学院硕士生吴美玲为该论文第一作者,施冬云为通讯作者。该研究获得了国家自然科学基金委和国家基础科学人才培养基金的资助。
参考文献
1. ROS-mediated glucose metabolic reprogram induces insulin resistance in type 2 diabetes. Biochem Biophys Res Commun 2016 2016-08-05;476(4):204-211.
2. Glutaredoxins concomitant with optimal ROS activate AMPK through S-glutathionylation to improve glucose metabolism in type 2 diabetes. Free Radic Biol Med 2016 2016-12-01;101:334-347.
3. Targeting hepatic glucose metabolism in the treatment of type 2 diabetes. NAT REV DRUG DISCOV 2016 2016-11-01;15(11):786-804.
责任编辑:刘晔瀚





