
在癌症治疗中,相当一部分肿瘤对免疫疗法没有响应,表现出耐药性,是目前亟需解决的一大难题。日前,复旦大学基础医学院朱棣教授研究团队与合作者研究发现了靶向BCL9激活cDC1协调免疫响应所需的正反馈回路,揭示免疫治疗耐药关键机制。同时,基于cDC1介导的免疫治疗耐药关键机制,团队针对激活cDC1协调免疫治疗耐药的机制进行了系统的创新药物分子的发现,开发了多个能克服耐药的创新强效抑制剂,为克服免疫疗法耐药性提供了潜在策略。近日,朱棣团队在肿瘤免疫耐药性研究的最新进展已分别发表在中国科学院一区医学期刊Signal Transduction and Targeted Therapy及药物化学专业期刊Journal of Medicinal Chemistry上,并分别被选为封面文章。
2024年5月29日,复旦大学基础医学院朱棣教授与王明伟教授作为共同通讯在细胞生物学权威期刊Signal Transduction and Targeted Therapy (STTT)发表题为“Targeting BCL9/BCL9L enhances antigen presentation by promoting conventional type 1 dendritic cell (cDC1) activation and tumor infiltration”的研究论文。研究团队对靶向BCL9/BCL9L所触发的cDC1激活与浸润,增强抗原呈递,延缓肿瘤生长并促进抗肿瘤CD8+T细胞应答的作用机制进行深入的探索。

BCL9/BCL9L作为Wnt/β-catenin信号通路的核心转录共激活因子,在肿瘤发生和免疫抑制过程中扮演关键角色。据报道,晚期肝癌中71.5%及结肠癌中40%的病例显示出BCL9基因表达异常上调,与患者不良预后及免疫耐药相关联。在先前的研究工作中,朱棣教授的研究团队发现靶向BCL9/BCL9L可通过多种机制促进抗肿瘤免疫反应,包括调节浆细胞转移、T细胞浸润、B细胞迁移、树突状细胞活化浸润等。因此通过靶向BCL9/BCL9L可能成为克服肿瘤免疫耐药的有效策略之一。
该研究论文中采用一种新型多肽抑制剂hsBCL9Z96,针对BCL9/BCL9L进行了药理学抑制研究。相比于之前研究报道的hsBCL9CT-24,hsBCL9Z96表现出更优异的细胞穿透力,并且在β-catenin和BCL9之间的相互作用中表现出强大的抑制效果。验证了靶向BCL9/BCL9L能够显著延缓肿瘤生长。然而,关于BCL9和BCL9L与肿瘤抗原呈递之间的具体内在联系尚未有文献报道,这仍需进一步深入探索。

图1. hsBCL9Z96 BCL9/BCL9L的药理学抑制显著抑制肿瘤生长的作用
研究人员首先通过对最近发表的TCGA COAD数据集分析发现,高表达的BCL9与抗原呈递呈现负相关。因此靶向BCL9/BCL9L很可能是通过增强抗原呈递抑制肿瘤生长与免疫治疗的耐药性。研究团队采用生物信息学与Bcl9/Bcl9l敲除小鼠对该观点进行进一步验证,证实了靶向BCL9/BCL9L能上调BTK表达激活TAK1/NF-κB/IRF1信号传导,激活cDC1的抗原呈递作用。受抗原呈递激活CD8+ T细胞增强XCL1的产生,并随后促进XCR1 cDC1募集到肿瘤部位。同时cDC1可产生CXCL9通过CXCL9-CXCR3轴将效应CXCR3 CD8+ T细胞募集到肿瘤微环境中,进一步促进了CD8+ T细胞增殖和IFN-γ分泌,增强小鼠体内抗肿瘤免疫反应。
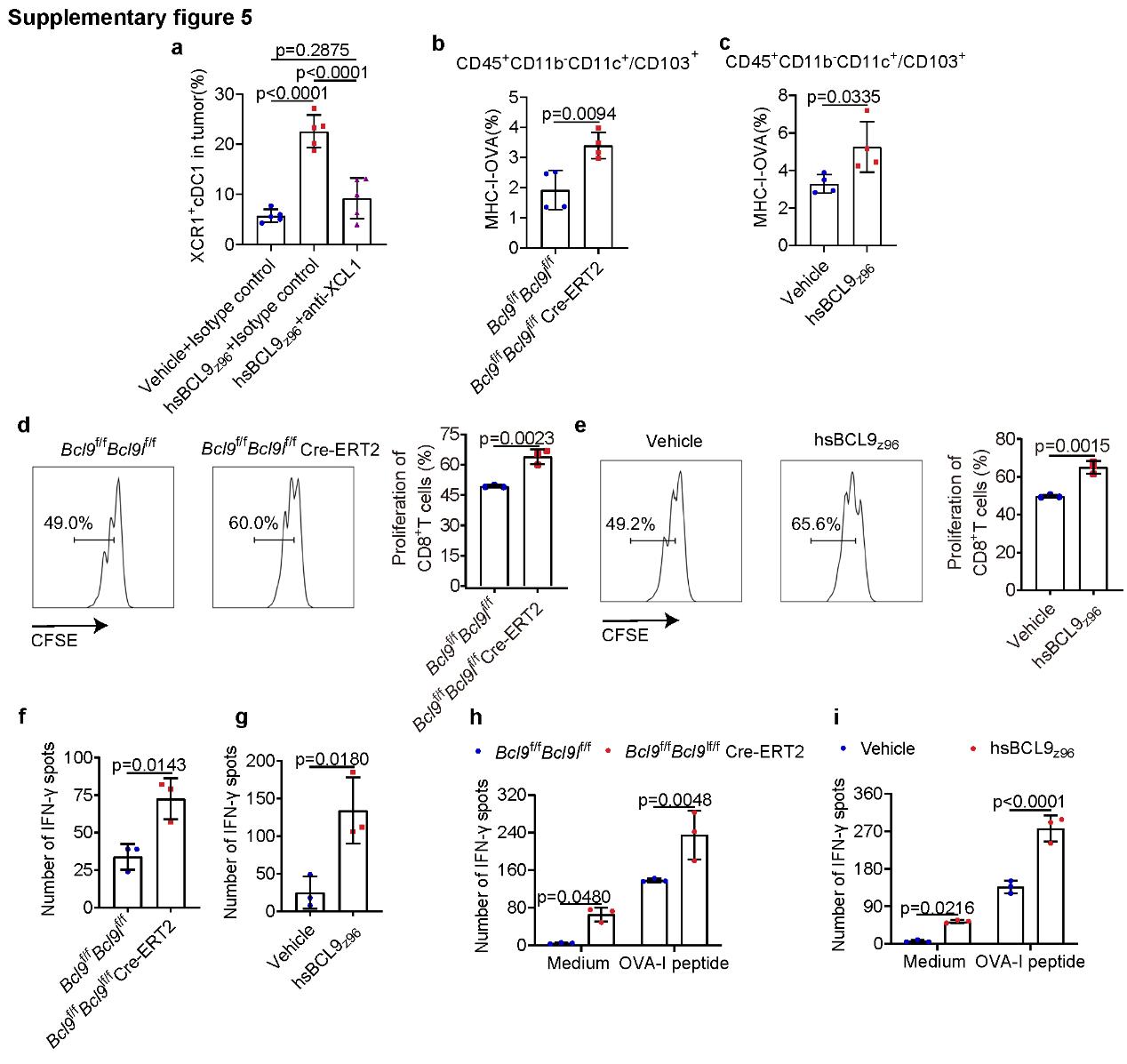
图2. BCL9/BCL9L的抑制促使cDC1的激活,并促进CD8+ T细胞的交叉启动

图3. 靶向BCL9/BCL9L 通过TAK1/NF-κB/IRF1通路促进cDC1的激活
本项研究由复旦大学何凤莲、吴重恩、刘成龙、朱远远为第一作者撰写完成并且还得到中国科学院上海药物所及国家化合物样品库的杨德华研究员的大力支持。
鉴于前期的研究基础,靶向BCL9/BCL9L激活cDC1,增强抗原呈递能力,并促进CD8+ T细胞的抗肿瘤反应的关键机制研究已取得显著进展。特别是新型研发的多肽抑制剂hsBCL9Z96针对β-catenin/BCL9相互作用的靶向抑制,显示出优异的抗肿瘤效果。为进一步推进该领域的研究,2024年6月24日,朱棣教授协同山东省药学科学院孟祥璟研究员及中国科学院上海药物研究所赵玉军研究员在药物化学权威期刊Journal of Medicinal Chemistry(JMC)新上线的论文中再次发表了关于β-catenin/BCL9相互作用的新型小分子抑制剂的研究和开发最新研究进展。研究团队展示了通过晶体解析、药物设计与构效关系优化等多个过程,成功设计出一系列具有强亲和力的β-catenin/BCL9小分子抑制剂,其中以3-苯基哌啶尿素支架衍生物为代表。进一步的药理学特性验证显示,其中的13和35衍生物不仅有效抑制了BCL9与β-catenin的结合,还展现出调节cDC1免疫耐药性的潜力。这些研究成果为开发靶向肿瘤免疫治疗的新型药物提供了重要的理论基础和实验依据。

基于前期生物信息学分析以及药理学抑制或基因敲除实验,验证了靶向BCL9/BCL9L在cDC1介导的肿瘤抗原呈递的关键作用,因此针对最新研发的小分子先导化合物13和35开展抗肿瘤免疫耐药的药效实验验证。肿瘤组织流式细胞术和qPCR结果显示13通过Btk-Irf1信号转导轴激活上调IFN-γ+的分泌和CD8+ T细胞增殖,显著促进了cDC1细胞的成熟和抗原呈递能力。另一方面,35通过激活Btk-Stat-Irf1信号转导轴,增强了cDC1的分化和成熟,并在PBMC和TdLN中提升了cDC1的比例,从而强化了T细胞介导的免疫反应。这些结果证实,靶向β-catenin/BCL9的小分子抑制剂能有效增强cDC1的活性,提升抗原呈递和CTL功能,有效抑制肿瘤生长并克服免疫治疗的耐药性。
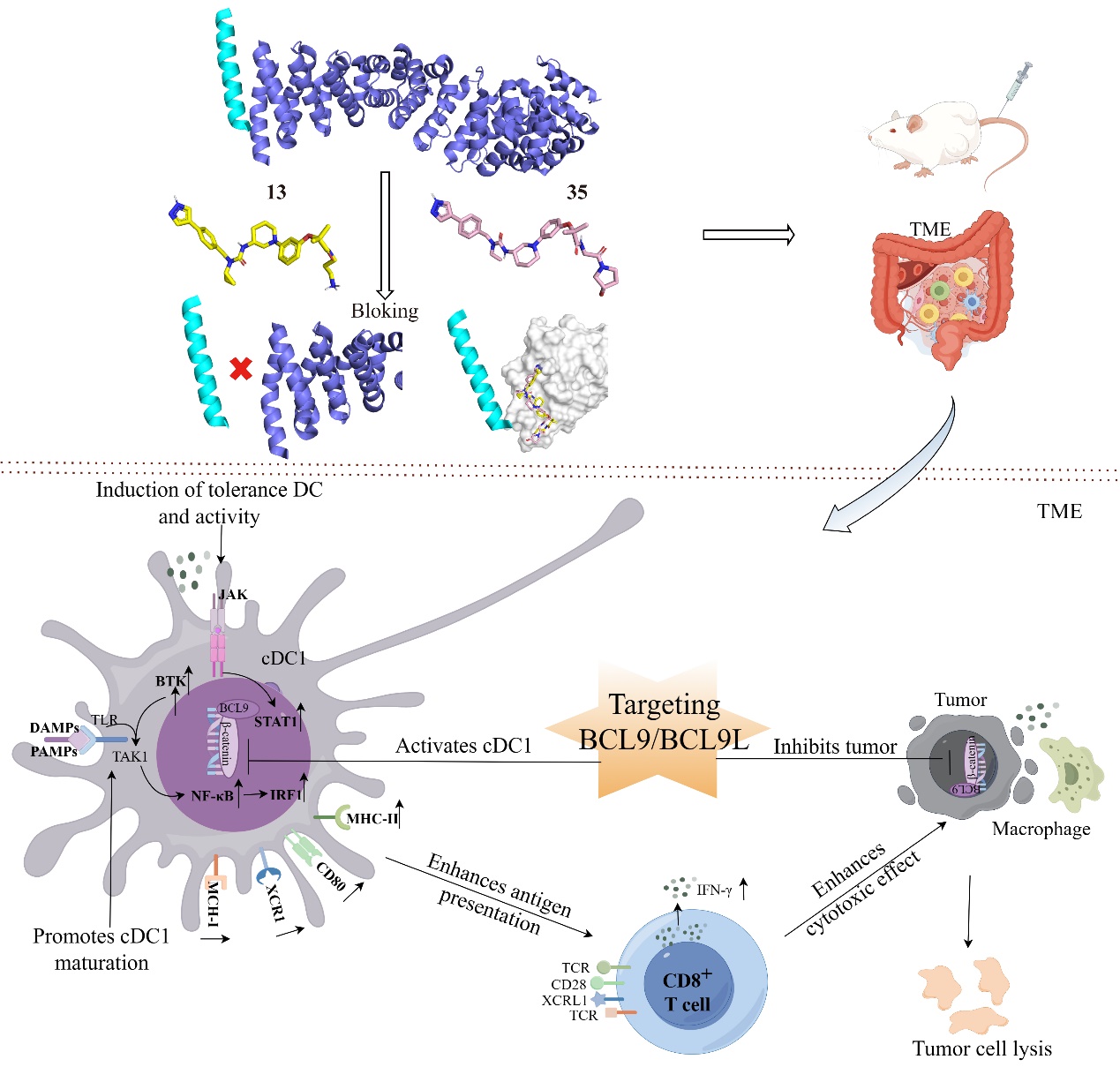
图4. 靶向β-catenin/BCL9可增强cDC1介导的CD8+ T细胞的免疫响应作用机制
值得注意的是,3-苯基哌啶尿素支架衍生物的成功改造得益于对β-catenin晶体的深入分析研究。研究人员基于2GL7结构,对PDB 蛋白数据库中的β-catenin N端的四个α螺旋进行了叠加分析,并将新解析的Apo β-catenin晶体(PDB IDs 8Z61, 8Z5J)进行进一步分析,通过分子动力学的研究,首次提出β-catenin N末端存在显著的构象多样性。该结果对于β-catenin/BCL9相互作用研究具有重要意义。为了研究抑制剂与Apo β-catenin构象的相容性,研究团队选择了分别从8Z61和8Z5J的分子动力学模拟中的主导聚类结构(DC I和DC II)用于分子设计。采用尿素优势骨架与ZW4864进行融合,最终成功获得了一系列高亲和力、高活性的具有3-苯基哌啶尿素结构的衍生物,并且有19个化合物的亲和力突破到200nM以下,13与35也包含在其中。值得注意的是,化合物28更是显示出目前该领域内最强的β-catenin结合亲和力(Kd=82nM)之一。
以上关于小分子抑制剂的研究由安徽中医药大学和长三角药物高等研究院的朱文华、刘翠婷、奚康、李雅娜和复旦大学李安琪、沈栎安作为论文第一作者进行撰写。本项研究还得到中国科学院上海药物所、山东省药学科学院、北京深势科技有限公司及长三角药物高等研究院的大力支持。
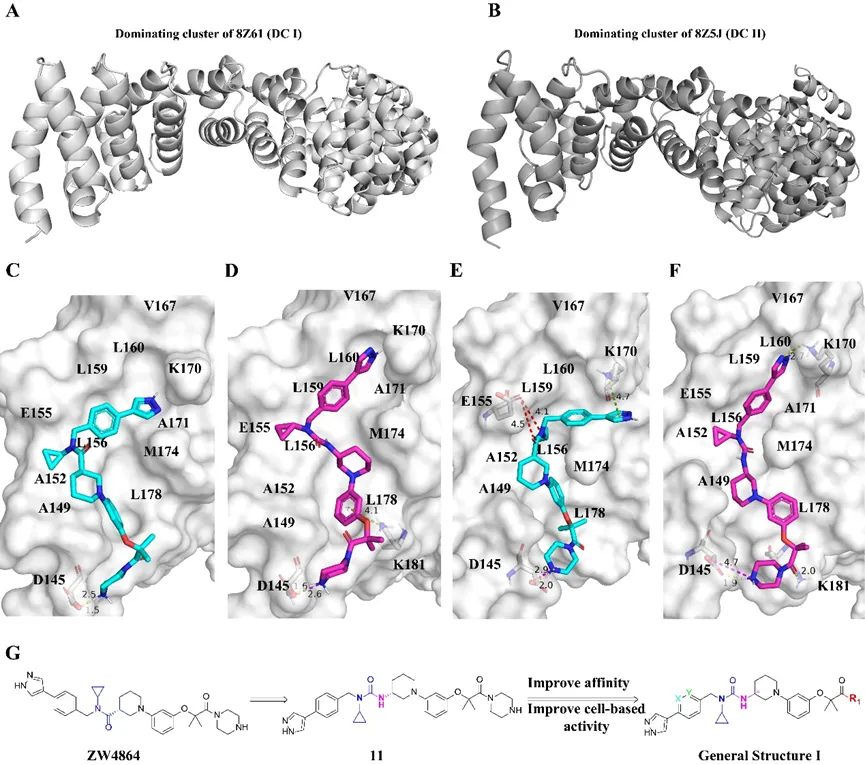
图5.β-catenin晶体结构解析(PDB IDs 8Z61, 8Z5J)和药物分子设计
朱棣课题组近5年来围绕“靶向BCL9如何调控肿瘤免疫编辑和如何促进肿瘤免疫治疗耐药”的科学问题,揭示了靶向BCL9/β-catenin促进PD-1疗效新机制(Sci. Adv.,Signal Transduct Target Ther.,Oncogene),以及在转移中的作用(Cell Rep.,Caner Lett.),并开展了多种手段(多肽、小分子化合物、天然化合物)针对BCL9/β-catenin蛋白-蛋白相互作用靶点的创新抑制剂开发(J Med Chem.,Eur J Med Chem.)。这一系列针对靶向BCL9/β-catenin研究工作具有较高的创新性和研究价值,系统性的工作逐渐揭示了靶向BCL9/β-catenin的药物开发蕴藏着潜力,为攻克Wnt信号通路的潜在的成药性技术难题提供了理论基础。
参考文献
[1] Zhu W, Liu C, Xi K, Li A, Shen LA, Li Y, Jia M, He Y, Chen G, Liu C, Chen Y, Chen K, Sun F, Zhang D, Duan C, Wang H, Wang D, Zhao Y, Meng X, Zhu D. Discovery of Novel 1-Phenylpiperidine Urea-Containing Derivatives Inhibiting β-Catenin/BCL9 Interaction and Exerting Antitumor Efficacy through the Activation of Antigen Presentation of cDC1 Cells. J Med Chem. 2024 Jun 24. doi: 10.1021/acs.jmedchem.3c02079.
[2] Feng M, Wu Z, Zhou Y, Wei Z, Tian E, Mei S, Zhu Y, Liu C, He F, Li H, Xie C, Jin J, Dong J, Yang D, Yu K, Qian J, Lambrechts D, Wang MW, Zhu D. BCL9 regulates CD226 and CD96 checkpoints in CD8+ T cells to improve PD-1 response in cancer. Signal Transduct Target Ther. 2021 Aug 20;6(1):313. doi: 10.1038/s41392-021-00730-0.
[3] Feng M, Jin JQ, Xia L, Xiao T, Mei S, Wang X, Huang X, Chen J, Liu M, Chen C, Rafi S, Zhu AX, Feng YX, Zhu D. Pharmacological inhibition of β-catenin/BCL9 interaction overcomes resistance to immune checkpoint blockades by modulating Treg cells. Sci Adv. 2019 May 8;5(5):eaau5240. doi: 10.1126/sciadv.aau5240.
[4] Shen LA, Peng X, Bao Y, Liu C, Zhang H, Li J, Zhu D, Zhang Q. Design, synthesis and biological evaluation of quercetin derivatives as novel β-catenin/B-cell lymphoma 9 protein-protein interaction inhibitors. Eur J Med Chem. 2023 Feb 5;247:115075. doi: 10.1016/j.ejmech.2022.115075.
[5] Zhang H, Liu C, Chen Q, Shen LA, Xiao W, Li J, Wang Y, Zhu D, Zhang Q, Li J. Discovery of Novel 3-Phenylpiperidine Derivatives Targeting the β-Catenin/B-Cell Lymphoma 9 Interaction as a Single Agent and in Combination with the Anti-PD-1 Antibody for the Treatment of Colorectal Cancer. J Med Chem. 2023 Jan 26;66(2):1349-1379. doi: 10.1021/acs.jmedchem.2c01568.





