近日,复旦大学基础医学院免疫学系严大鹏教授团队发现了HIV逃逸宿主固有免疫反应的新型机制。该研究成果于2023年4月25日以Glutamylation of an HIV-1 protein inhibits immune response by hijacking STING为题发表在Cell子刊Cell Reports杂志上。
自上世纪90年代以来,鸡尾酒疗法虽大大减少了艾滋病患者体内的病毒载量及艾滋病的致死率。但由于HIV的长期潜伏能力,当前的联合治疗并不能够彻底清除病毒和治愈艾滋病。为了更有效地遏制艾滋病的传播,对其免疫逃逸的分子机制的研究需求非常迫切。尽管已经有大量研究致力于探究HIV对固有免疫的抑制作用,但HIV具体通过哪个自身蛋白实现免疫逃逸及其具体分子机制还有待进一步阐明。
该研究发现HIV-1感染宿主细胞后能够招募微管蛋白酪氨酸连接酶样蛋白6(tubulin tyrosine ligase-like enzyme 6,TTLL6)对HIV p6蛋白第六位氨基酸进行谷氨酰胺化修饰,发生修饰后的HIV p6蛋白通过抑制STING蛋白与AMFR(autocrine motility factor receptor, AMFR)及TRIM32(tripartite motif protein 32, TRIM32)的相互作用,降低STING蛋白K337位点K27及K63类型泛素化水平,从而负调控STING所介导的抗病毒信号通路的活化水平,以帮助HIV实现成功感染。而这一过程可被胞质羧肽酶激动剂(cytosolic carboxypeptidases,CCPs)CoCl2逆转,从而阻断HIV的免疫逃逸,起到抗病毒作用。
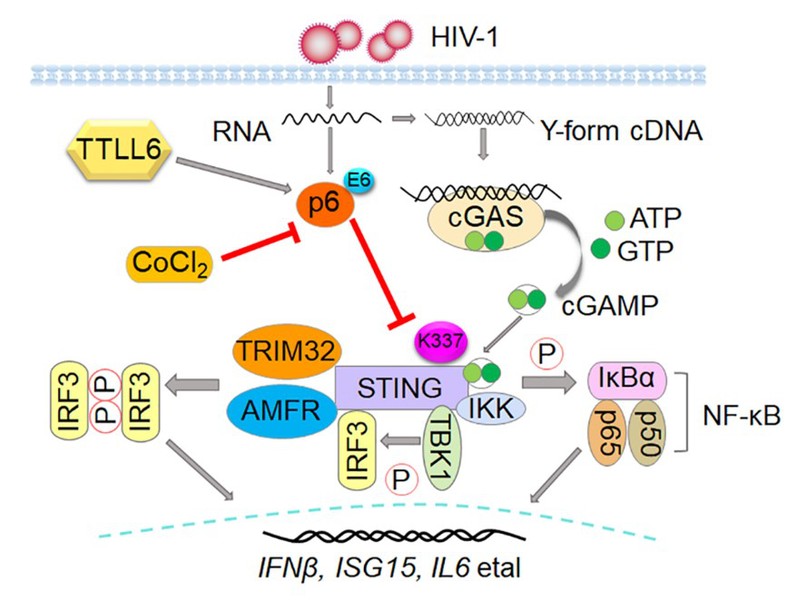
该研究不仅揭示了HIV逃逸宿主免疫应答的新机制,更为研发治疗HIV的药物提供了新的候选分子及药物靶点。
博士生钱贵、博士后张懿华和硕士生刘一楠为本论文共同第一作者,严大鹏教授为本论文通讯作者,复旦大学附属中山医院生物治疗中心徐建青教授、同济大学附属肺科医院戈宝学教授和深圳市第三人民医院张政教授共同参与本合作研究工作。






