
VHL的失活在肾透明细胞癌(ccRCC)中非常常见。据报道,高达90%的ccRCC中存在着VHL的失活突变。VHL是一种泛素连接酶(E3),在常氧条件下,HIF1/2α被羟基化,VHL靶向羟基化的HIF1/2α,使其发生泛素化降解。在ccRCC中,VHL的失活性突变可导致HIF1/2α的积累,从而使HIF信号通路异常活跃,通过重编程肿瘤细胞代谢,促进ccRCC的发生发展。
TET2蛋白属于TET双加氧酶家族成员,该家族在介导DNA去甲基化过程中发挥重要作用。TET2在血液肿瘤中频繁发生突变,在实体瘤中的突变较少,但是其活性显著下调,提示其在肿瘤发生发展中具有重要作用。在前期研究中,复旦大学基础医学院吕雷研究员和同济大学徐艳萍教授揭示了TET2抑制急性髓系白血病AML(Molecular Cell, 2015),病毒感染和炎症(Molecular Cell, 2018),以及促进肿瘤免疫(JCI, 2019)的具体机制。
近日,复旦大学基础医学院吕雷团队与同济大学徐艳萍团队联合在Cancer Research上发表了题为TET2 suppresses VHL deficiency-driven clear cell renal cell carcinoma by inhibiting HIF signaling的研究成果。该研究揭示了TET2通过调控FBP1的表达抑制HIF信号通路介导的代谢重编程,为VHL缺失TET2野生型的ccRCC的临床治疗提供了新策略。

研究人员通过TCGA数据分析发现,TET2的表达仅在ccRCC中与患者的生存期成正相关。后续的分子生物学实验发现,TET2以VHL缺失依赖的方式抑制肿瘤糖酵解和磷酸戊糖途径。深入的机制研究发现,TET2可被转录因子HNF4α招募至FBP1启动子区,促进FBP1启动子的去甲基化,从而上调FBP1的表达,而FBP1可以进入细胞核抑制HIF信号通路及其介导的代谢重编程,抑制ccRCC的发生发展。论文发表后受到美国癌症研究协会年会(AACR 2022)报告邀请。
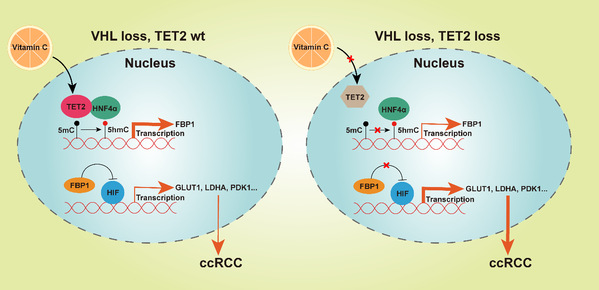
总结来说,该研究发现在VHL缺失、TET2野生型的ccRCC 中,TET2可被HNF4α招募到FBP1启动子区,激活FBP1的表达,FBP1与HIF1/2α相互作用并抑制其靶基因的表达,进而抑制肿瘤代谢,抑制ccRCC进展。维生素C可通过激活TET2促进该过程,抑制ccRCC发生发展。在VHL缺失、TET2缺失的ccRCC中,TET2功能的缺失导致FBP1的表达减少,引起HIF靶基因表达的升高和代谢重编程,促进 ccRCC的进展。维生素C不能抑制这种类型的ccRCC。
作者信息:复旦大学基础医学院博士后张新潮,瑞金医院放射肿瘤科李淑艳为本文的共同第一作者。复旦大学基础医学院吕雷研究员、同济大学生命科学与技术学院徐艳萍教授为共同通讯作者。复旦大学基础医学院为第一作者单位。该工作得到了复旦大学基础医学院雷群英教授,武汉大学医学研究所张静教授,以及德克萨斯大学西南医学中心病理学系张青教授的合作支持。
原文链接:





