
2023年11月13日,复旦大学基础医学院人体解剖与组织胚胎学系尤琳雅青年研究员课题组,复旦大学附属华山医院吴劲松教授团队和卡尔加里大学医学院Edwin Wang教授团队在《Frontiers of Medicine》上发表了题为“Distinct immune escape and microenvironment between RG-like and pri-OPC-like glioma revealed by single-cell RNA-seq analysis”的研究论文。该研究发现胶质瘤可分为两种亚型-放射性胶质细胞(RG)样和原始少突胶质前体细胞(pri-OPC)样。两种亚型的肿瘤突变模式、亚克隆进化和免疫逃逸机制存在显著差异。更有意思的是,两种肿瘤亚型以不同方式调控其肿瘤浸润淋巴细胞(TILs)。这些TIL细胞异常表达了正常免疫细胞不表达的特定基因,且这些表达模式与免疫检查点基因表达呈正相关,与患者生存率呈负相关。该研究提供了一种新的肿瘤免疫逃逸机制。
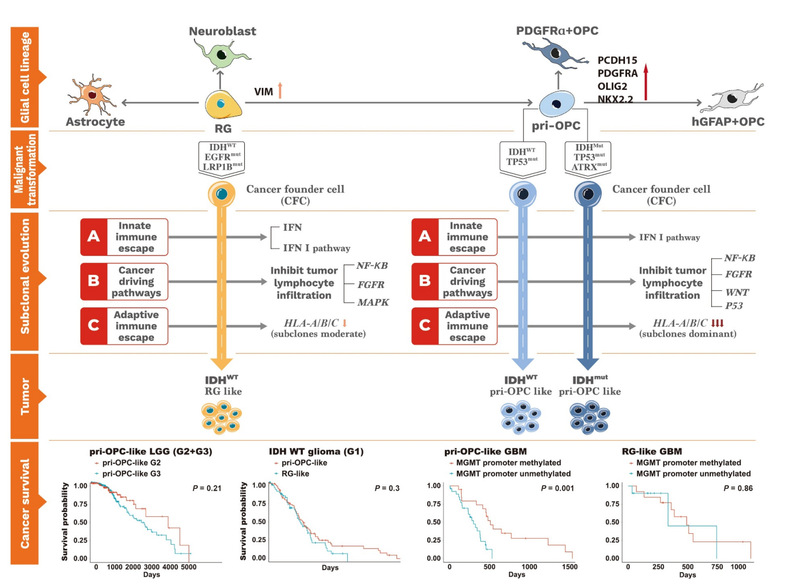
研究通过对 26 例胶质瘤患者的胶质瘤组织进行单细胞 RNA-seq分析,将其分类为pri-OPC-like和RG-like两种亚型,并在公共队列和 TCGA 数据库中进行验证。RG样肿瘤多为IDH野生型,倾向于携带EGFR突变,而pri-OPC样肿瘤易携带TP53突变。pri-OPC样肿瘤较RG样肿瘤而言,其肿瘤亚克隆呈现更为显著的MHC-I基因表达下调,提示两者具有不同的免疫逃逸机制。此外,更为重要的是,两者似乎以不同机制调控各自的肿瘤浸润淋巴细胞(TILs)。一些正常免疫细胞中不表达的特定基因在TILs中异常高表达,例如,神经胶质/神经胶质瘤干细胞标志物 OLIG1/PTPRZ1 和 B 细胞特异性受体 IGLC2/IGKC 分别在 pri-OPC 样和 RG 样胶质瘤的TILs中高表达,且它们的高表达与免疫检查点相关基因(如LGALS3)的表达呈正相关,与患者的生存率呈负相关。我们在Jurkat 细胞(一种T细胞细胞系)中过表达B细胞受体IGKC 可导致LGALS3等基因的表达上调,验证了我们的发现。该研究为胶质瘤的肿瘤免疫逃逸机制提供了一种新思路。
复旦大学基础医学院人体解剖与组织胚胎学系尤琳雅青年研究员、卡尔加里大学Cumming医学院Edwin Wang教授以及复旦大学附属华山医院神经外科吴劲松教授为该论文的共同通讯作者。复旦大学基础医学院人体解剖与组织胚胎学系博士研究生咸伟伟和硕士研究生白智心、复旦大学附属华山医院神经外科博士研究生吴帅、卡尔加里大学Cumming医学院博士研究生Mohammad Asad为该论文的共同第一作者。感谢复旦大学、国家科技部脑科学与类脑技术重大项目、上海市科委重大项目等经费支持。
全文链接:
https://link.springer.com/article/10.1007/s11684-023-1017-7





