
近年来,以PD-1/PD-L1免疫检查点抑制剂为代表的肿瘤免疫治疗实现了重要突破,黑色素瘤、肺癌、肝癌等十余种癌症的患者都受益于此。然而,临床上仍有相当部分的肝癌患者对PD-1/PD-L1抑制剂不应答或者迅速产生耐药,限制了免疫治疗在肝癌上应用。干扰素α在临床上的应用由来已久。1986年,干扰素α就作为经美国FDA批准的第一种肿瘤免疫治疗药物,用于治疗毛细胞白血病(hairy cell leukemia)。目前,干扰素α已被多国批准广泛应用于各种恶性肿瘤的治疗。
2022年4月12日,复旦大学附属中山医院樊嘉院士、复旦大学基础医学院药理学系朱棣以及复旦大学附属中山医院徐泱副教授团队在肿瘤学顶级期刊Cancer Discovery(IF=39.40)在线发表题为 “Interferon-α potentiates anti-PD-1 efficacy by remodeling glucose metabolism in the hepatocellular carcinoma microenvironment” 的研究论文。研究人员开展针对肝癌PD-1/PD-L1抑制剂耐药的肿瘤免疫药理学研究,发现干扰素α联用增强PD-1抗体药效,通过临床队列证实干扰素α具有改善肝癌PD-1抗体耐药的作用。后续通过构建多种小鼠肝癌模型,结合流式质谱、scRNA-seq分析等手段,该研究揭示了干扰素α能够通过纠正微环境中细胞与CD8+T细胞之间的糖代谢竞争,重塑肝癌免疫微环境,从而达到提高PD-1抗体疗效的联合治疗新策略。

研究人员进一步构建了自发小鼠肝癌模型与基于小鼠肝癌细胞系的原位移植瘤模型,并分别给予干扰素α、PD-1抗体以及两者联合给药治疗,探索肿瘤药理学机制。与临床上发现一致的是,在两种不同类型的小鼠肝癌模型中均显示联合治疗组小鼠肿瘤明显缩小、肺转移减少、生存期显著延长。
值得注意的是,研究人员在药理学机制研究中发现上述联合作用在免疫缺陷鼠以及清除了CD8+T细胞的小鼠体内完全消失,这提示干扰素α对PD-1抗体的增敏作用依赖于CD8+T细胞。为深究其中隐藏的潜在机理,研究团队运用流式质谱技术详细地剖析了不同治疗组肿瘤微环境中浸润的各亚群淋巴细胞,发现CD27+CD8+T细胞这一具有有效的免疫杀伤功能的亚群在联合治疗后的肝癌组织中浸润明显增加。此外,基于公共单细胞数据集的分析证据也同样支持这一发现:在免疫治疗有响应的患者中CD27+CD8+T细胞比例显著升高。
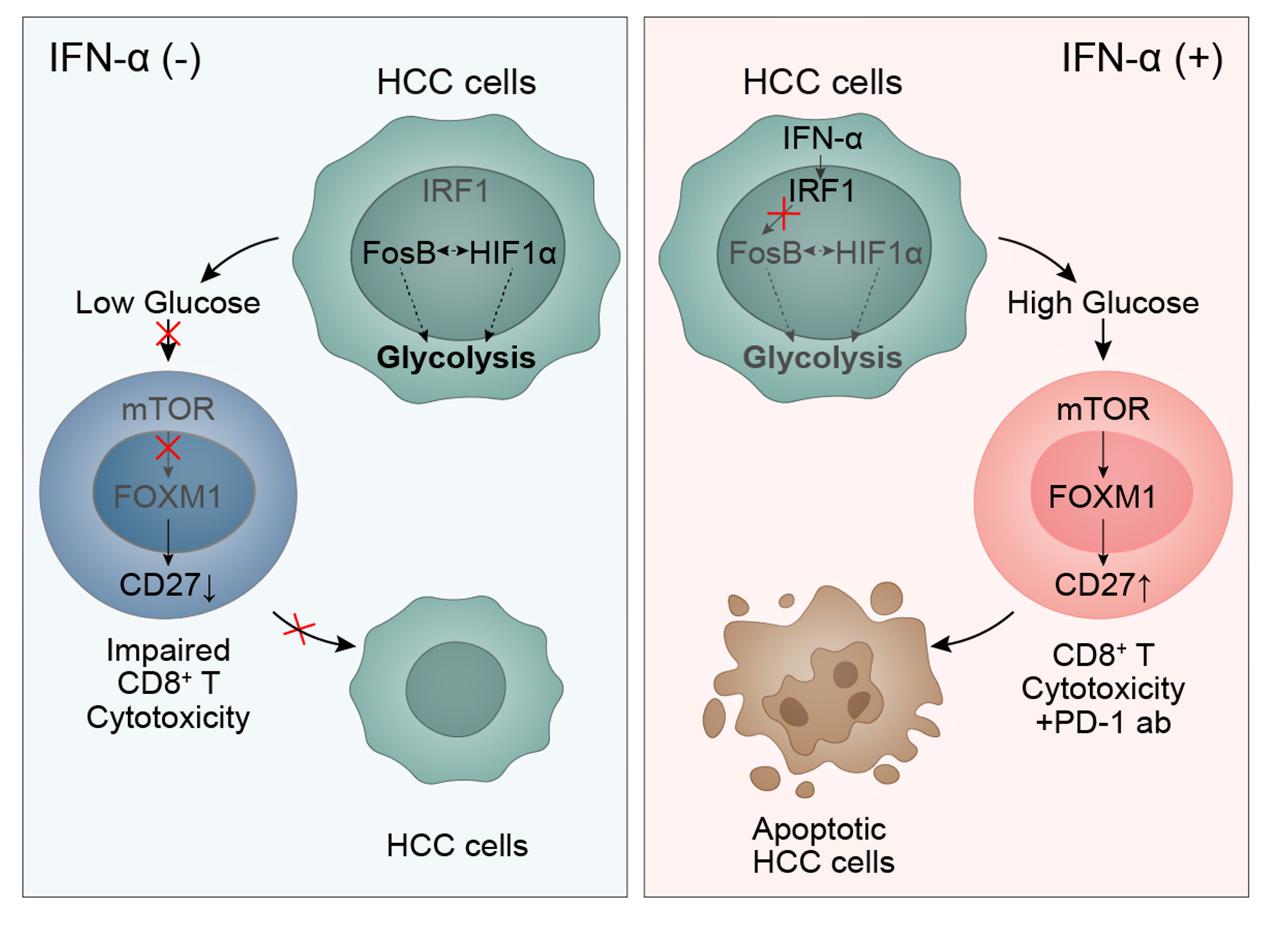
将目光聚焦于此后,研究团队进一步追问干扰素α提高CD27+CD8+T细胞浸润的分子药理学机制。通过转录组测序,研究人员发现对PD-1抗体耐受的肝癌细胞具有显著增强的糖酵解能力。一系列的体内、外功能实验证实此类肝癌细胞对微环境内的葡萄糖具有显著的消耗能力,从而竞争性地剥夺CD8+T细胞的能量供应,影响它们的活化与增殖。干扰素α则对此“肿瘤-免疫微环境”之间糖代谢竞争失衡具有纠正作用。干扰素α通过选择性地作用于肝癌细胞膜表面的特异性干扰素受体IFNAR1,通过激活IRF1抑制FosB转录,而FosB是糖酵解通路关键转录因子HIF1α的活化所必须的,导致细胞整体糖酵解相关代谢关键基因的表达下降,从而有效削弱了肝癌细胞对微环境中葡萄糖的利用,进而提高了肿瘤微环境葡萄糖浓度。这使得肿瘤浸润CD8+T细胞能够摄取到足够的葡萄糖并激活mTOR-FOXM1途径,促进CD8+T细胞中的Cd27基因转录,最终引起肿瘤微环境中CD27+CD8+T细胞浸润明显增加。
正所谓“道高一尺,魔高一丈”,研究团队在药理机制研究中意外地发现CD27+CD8+T细胞亚群尽管具有有效的免疫效应功能,但它们也同时高表达PD-1这一经典“刹车分子”,可能反馈性地使该亚群细胞在干扰素α单药使用时不能获得其真正的“实力”,一定程度上限制了干扰素α单药作用。而PD-1抗体药物的出现则解决了这一问题,使CD27+CD8+T细胞亚群得到“解放”,从而更好地发挥免疫效应功能。由此可见,干扰素α与PD-1抗体两者配合默契,在临床队列与模式动物中均展现出显著的抗肿瘤效果。
复旦大学附属中山医院胡博主治医师、中山医院喻敏成博士研究生、中山医院马晓路博士、中山医院孙嘉磊博士研究生、药学院刘成龙博士研究生为该文共同第一作者。
参考资料:[1] Bo Hu et al., (2022) Interferon-a potentiates anti-PD-1 efficacy by remodeling glucose metabolism in the hepatocellular carcinoma microenvironment. Cancer Discov candisc.1022.2021.s
附:朱棣老师简历
本文共同通讯作者,朱棣,国家青年特聘专家,复旦卓识人才,致力于肿瘤免疫药理学研究,他的实验室在肿瘤免疫创新疗法方向开展一系列研究,基于前期的第一/共一作者文章Nature Medicine, Science Translational Medicine为基础,回国后构建了肿瘤免疫药理学的研究平台,复旦大学通讯作者研究成果相继发表在Cancer Discovery, Signal Transduction and Targeted Therapy, Science Advances, Oncogene, British Journal of Pharmacology, Pharmacological Research等杂志。申请专利10项,并已经完成部分研究成果的转化,其中两项成果进入非注册临床试验。同时,朱棣兼任中国药理学会化药专业委员会专业委员; 中国老年学和老年医学学会肿瘤分会专业委员;美国 ASCO协会会员和AACR协会会员。





