
2022年4月27日(北京时间),复旦大学基础医学院王明伟团队携手中国科学院上海药物研究所杨德华团队和徐华强团队于Nature Communications在线发表了题为“A distinctive ligand recognition mechanism by the human vasoactive intestinal polypeptide receptor 2”的研究论文。该论文首次报道了人源血管活性肠肽受体2(Vasoactive intestinal polypeptide receptor 2, VIP2R)与其内源性配体PACAP27和Gs蛋白复合物的高分辨冷冻电镜结构,揭示了其独特的配体识别机制¾¾受体胞外域(Extracellular domain, ECD)氨基端α螺旋插入跨膜域(Transmembrane domain, TMD)以识别配体。这一发现丰富了B1类G蛋白偶联受体的配体识别和受体激活机制,为相关新药的研发奠定了结构生物学基础。同时,VIP2R的三维结构是该受体家族15个成员中最后一个得到解析的。

血管活性肠肽(Vasoactive intestinal peptide, VIP)和垂体腺苷酸环化酶激活多肽(Pituitary adenylate cyclase-activating polypeptide, PACAP)是两种重要的神经肽,通过三个B1类G蛋白偶联受体(G protein-coupled receptor, GPCR),即PACAP 1型受体(PACAP type 1 receptor, PAC1R)、血管活性肠多肽受体1(Vasoactive intestinal polypeptide receptor 1,VIP1R)和VIP2R发挥多种生理功能1。尽管它们的氨基酸序列相似性高达~50%,但介导着迥异的生物效应,如神经发育、钙稳态、葡萄糖代谢、昼夜节律、体温调节、炎症、进食行为、疼痛、压力和相关的内分泌反应2-6。VIP2R由438个氨基酸组成,主要分布在中枢和外周神经系统,参与肺动脉高压、自身免疫和精神神经系统等疾病的病理过程。靶向这三个受体的药物发现主要针对呼吸窘迫综合征、头痛和偏头痛,但受限于多肽容易降解和靶标特异性差等缺陷,目前VIP、PACAP38及类似物PB1046均停滞于I或II期临床试验,而小分子化合物则处在临床前研究阶段,尚无上市产品。
参加这项研究的科研人员经过多轮载体筛选和应用NanoBiT系连技术7获得了颗粒均一且性状稳定的VIP2R蛋白复合物。借助中国科学院上海药物研究所300 kV冷冻电镜拍摄到的清晰图像和后继单颗粒三维重构获得了分辨率为2.7 Å的PACAP27–VIP2R–Gs复合物结构(图1),显示PACAP27的氨基段(前13个残基)锲入TMD正构结合位点,而羧基段则被受体ECD(尤其是氨基端α螺旋)和第一胞外环(Extracellular loop 1, ECL1)所稳定。该论文还报道了在受体氨基端添加Flag tag和8×His tag修饰的PACAP27–N-terminal modified VIP2R24-438–Gs三元复合的冷冻电镜物结构(分辨率为3.4 Å),进一步展示了VIP2R独特的配体识别界面(PACAP27-ECD-ECL1)。
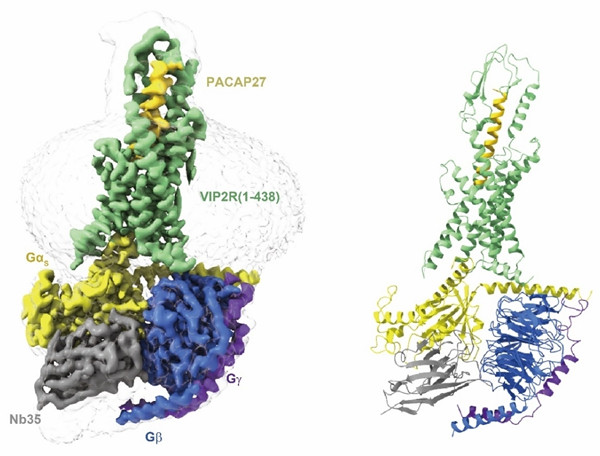
图1. PACAP27激活的VIP2R与Gs蛋白的冷冻电镜结构。左,PACAP27–VIP2R–Gs复合物冷冻电镜密度剖视图;右,PACAP27–VIP2R–Gs复合物模型。
研究表明,与以往解析的B1类G蛋白偶联受体结构不同,VIP2R的氨基端α螺旋较深地插入到配体PACAP27和ECL1之间的缝隙(图1),对稳定受体激活态构象至关重要。功能分析显示,VIP2R的氨基端α螺旋分别截短或延长2、5或10个氨基酸时,cAMP信号转导受到影响(图2)。相比之下,同家族的VIP1R和PAC1R对配体的识别和信号转导均无需氨基端α螺旋甚至ECD之参与。有趣的是,将VIP2R的氨基端α螺旋或整个ECD替换为PAC1R的相应区域分别完全消除或极大降低了PACAP27所引起的cAMP信号转导,说明氨基端α螺旋长度和组成对VIP2R的功能发挥起着重要的作用。
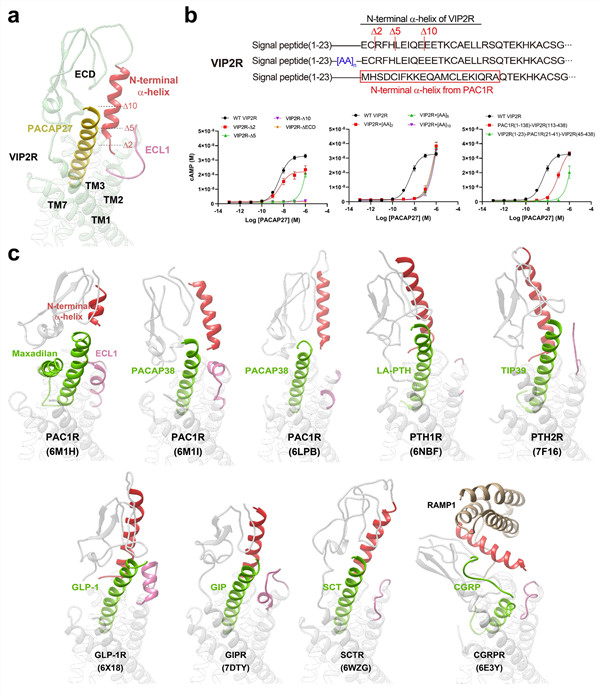
图2. VIP2R在B1类G蛋白偶联受体家族成员中独具的氨基端α螺旋构象。a,VIP2R的PACAP27-ECD-ECL1界面特写视图;b,VIP2R氨基端α螺旋延长、截短或替换成PAC1R对应区域对受体cAMP信号转导的影响;c,B1类G蛋白偶联受体结构中氨基端α螺旋、ECL1和多肽构象的比较。
复旦大学基础医学院博士研究生许映娜、冯文博和复旦大学基础医学院青年研究员周庆同为该论文的共同第一作者;复旦大学王明伟讲席教授、中国科学院上海药物研究所杨德华研究员和徐华强研究员为该论文的共同通讯作者。合作者包括中国科学院上海药物研究所赵丽华副研究员、蒋轶研究员和华中科技大学夏天教授等。该研究成果先后获得了国家自然科学基金委员会、国家科学技术部、国家卫生与健康委员会、中国科学院和上海市科学技术委员会等机构的经费资助。
原文链接:https://doi.org/10.1038/s41467-022-30041-z
参考文献
1.Vaudry, D. et al. Pituitary adenylate cyclase-activating polypeptide and its receptors: 20 years after the discovery. Pharmacol Rev61, 283-357 (2009).
2.Harmar, A.J. et al. Pharmacology and functions of receptors for vasoactive intestinal peptide and pituitary adenylate cyclase-activating polypeptide: IUPHAR review 1. Br J Pharmacol166, 4-17 (2012).
3.Hollenstein, K. et al. Insights into the structure of class B GPCRs. Trends Pharmacol Sci35, 12-22 (2014).
4.Culhane, K.J., Liu, Y., Cai, Y. & Yan, E.C. Transmembrane signal transduction by peptide hormones via family B G protein-coupled receptors. Front Pharmacol6, 264 (2015).
5.Liao, C., May, V. & Li, J. PAC1 Receptors: Shapeshifters in Motion. J Mol Neurosci68, 331-339 (2019).
6.Liao, C. et al. Targeting the PAC1 Receptor for Neurological and Metabolic Disorders. Curr Top Med Chem19, 1399-1417 (2019).
7.Duan, J. et al. Cryo-EM structure of an activated VIP1 receptor-G protein complex revealed by a NanoBiT tethering strategy. Nat Commun11, 4121 (2020).





