
胰岛素抵抗是2型糖尿病的发病基础,也是多种代谢相关性疾病如肥胖、非酒精性脂肪肝病等的共同病理基础,更是心血管疾病的危险因素之一。但目前肝脏胰岛素抵抗的发生机制尚未完全阐明,深入研究肝脏胰岛素抵抗的分子机制对于胰岛素抵抗相关疾病的防治具有十分重要的意义。
2023年12月21日,复旦大学基础医学院孟丹教授团队在《自然通讯》(Nature Communications,IF 16.6)杂志在线发表了题为《BACH1在小鼠中调控肝脏胰岛素信号通路和葡萄糖稳态》(BACH1 Controls Hepatic Insulin Signaling and Glucose Homeostasis in Mice)的最新研究成果。这项工作表明靶向抑制肝脏BACH1能够明显改善高脂饮食喂养小鼠和db/db糖尿病小鼠的肝脏胰岛素敏感性,改善葡萄糖耐量和糖代谢的异常以及肝脂肪变性。研究阐明了BACH1作为胰岛素信号通路的负调控因子,在调控肝脏胰岛素敏感性和葡萄糖代谢中的重要作用,为胰岛素抵抗相关疾病的防治提供了新的靶点。

转录因子BACH1(BTB and CNC homology 1)属于碱性亮氨酸拉链蛋白家族,广泛存在于哺乳动物组织中,其抑制红细胞、巨噬细胞和脂肪细胞的分化【1-3】。孟丹教授研究团队前期围绕转录因子BACH1进行一系列的研究,证实 BACH1通过调控表观遗传学修饰维持胚胎干细胞多能性【4】;BACH1激活内皮细胞炎症并促进动脉粥样硬化【5】;BACH1通过调控染色质开放性影响血管平滑肌细胞表型转换,促进血管损伤后新生内膜增生【6】。然而,BACH1是否在胰岛素抵抗中发挥作用目前还不清楚。
研究人员发现代谢紊乱患者和非酒精性脂肪肝患者的肝脏、高脂喂养小鼠、db/db和ob/ob糖尿病小鼠的肝脏、以及高糖高脂饮食小鼠的肝细胞和油酸处理的小鼠肝细胞中BACH1表达均明显上调。研究人员还发现,在高脂饮食诱导的小鼠胰岛素抵抗模型和db/db糖尿病小鼠中,肝细胞特异性敲除BACH1可显著改善小鼠的肝重增加、葡萄糖耐量和胰岛素敏感性下降、糖原储存能力下降等表型,降低小鼠血糖,并抑制糖异生相关基因的表达;同时增加高脂饮食喂养的小鼠肝脏中胰岛素刺激的胰岛素受体β(IR-β),蛋白激酶B(AKT),糖原合成酶激酶-3(GSK-3β)和人叉头框蛋白O1(FOXO1)的磷酸化。而肝细胞过表达BACH1则起相反作用。此外,在小鼠原代肝细胞、人HepG2细胞、小鼠骨骼肌细胞和脂肪前体细胞上,亦发现BACH1可以负调节肝细胞胰岛素信号通路。
机制上,研究人员发现BACH1能够与蛋白酪氨酸磷酸酶PTP1B和胰岛素受体IR-β结合,BACH1的过表达促进了IR-β在核周的积累,并增强了PTP1B和IR-β在核周的相互作用,该作用是由BACH1 蛋白N端的BTB结构域介导的。肝细胞特异性敲除BACH1减少了胰岛素刺激的肝脏PTP1B和IR-β的结合。进一步体内实验发现,在高脂饮食诱导的小鼠模型中,肝细胞特异性敲低PTP1B可以部分改善高脂饮食诱导下BACH1过表达小鼠受损的肝脏胰岛素敏感性、葡萄糖耐量、肝糖原储存能力等表型,部分逆转BACH1对肝脏胰岛素信号通路的抑制作用。
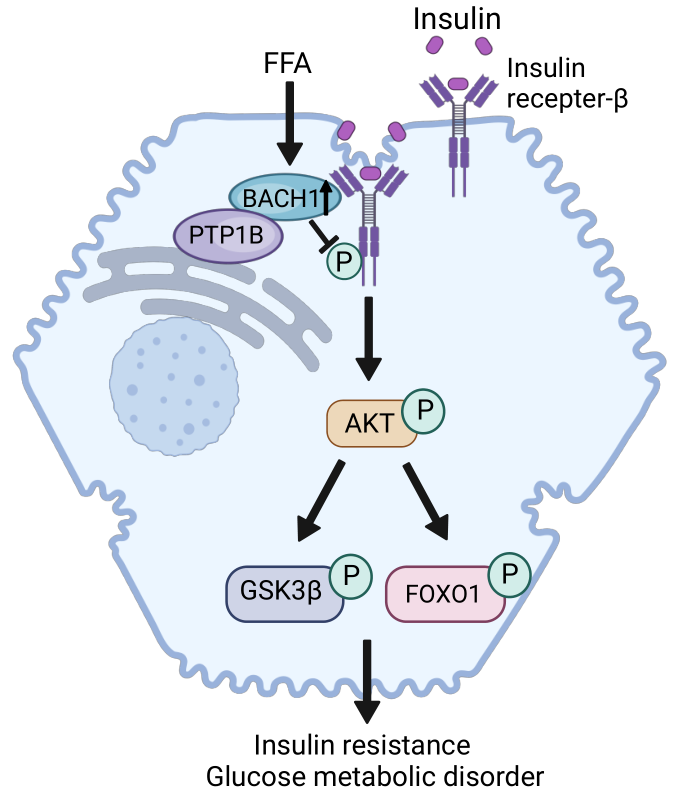
BACH1促进小鼠肝脏胰岛素抵抗的机制示意图
综上,在高脂饮食诱导下BACH1在肝脏中表达增高;BACH1通过促进肝细胞PTP1B与IR-β结合,抑制肝细胞胰岛素信号通路,加剧高脂饮食诱导的小鼠胰岛素抵抗。肝细胞特异性敲除BACH1或抑制肝脏BACH1表达有助于增加高脂饮食喂养小鼠和糖尿病小鼠肝脏中的胰岛素敏感性,降低血糖,改善葡萄糖耐量和糖代谢的异常。这项研究阐明了BACH1在调控肝脏胰岛素敏感性和葡萄糖代谢中的重要作用,为胰岛素抵抗相关疾病的防治提供了新的靶点。
复旦大学基础医学院金嘉玉博士、何韫荃博士和郭阶雨博士后为本文的共同第一作者,复旦大学基础医学院孟丹教授和支秀玲副教授为本文的共同通讯作者。复旦大学为第一作者单位。该研究得到了瑞士苏黎世大学Elena Osto教授、中科院营养与健康研究所丁秋蓉研究员、上海市第六人民医院张明亮医师等人的大力支持;同时得到了来自国家自然科学基金重大研究计划重点项目,国家自然科学基金重点国际合作项目、上海市优秀学术带头人项目、上海市科委科技创新行动计划以及复旦大学卓识杰出人才项目等基金的资助。
原文链接:https://doi.org/10.1038/s41467-023-44088-z
参考文献
Igarashi, K., Hoshino, H., Muto, A., Suwabe, N., Nishikawa, S., Nakauchi, H. and Yamamoto, M. (1998). Multivalent DNA binding complex generated by small Maf and Bach1 as a possible biochemical basis for beta-globin locus control region complex. J. Biol. Chem. 273, 11783-11790.
Haldar, M., Kohyama, M., So, A.Y., Kc, W., Wu, X., Briseno, C.G., Satpathy, A.T., Kretzer, N.M., Arase, H. and Rajasekaran, N.S., et al. (2014). Heme-mediated SPI-C induction promotes monocyte differentiation into iron-recycling macrophages. Cell 156, 1223-1234.
Matsumoto, M., Kondo, K., Shiraki, T., Brydun, A., Funayama, R., Nakayama, K., Yaegashi, N., Katagiri, H. and Igarashi, K. (2016). Genomewide approaches for BACH1 target genes in mouse embryonic fibroblasts showed BACH1-Pparg pathway in adipogenesis. Genes Cells 21, 553-567.
Wei, X., Guo, J., Li, Q., Jia, Q., Jing, Q., Li, Y., Zhou, B., Chen, J., Gao, S. and Zhang, X., et al. (2019). Bach1 regulates self-renewal and impedes mesendodermal differentiation of human embryonic stem cells. Sci. Adv. 5, eaau7887.
Jia M, Li Q, Guo J, Shi W, Zhu L, Huang Y, Li Y, Wang L, Ma S, Zhuang T, Wang X, Pan Q, Wei X, Qin Y, Li X, Jin J, Zhi X, Tang J, Jing Q, Li S, Jiang L, Qu L, Osto E, Zhang J, Wang X, Yu B, Meng D. Deletion of BACH1 Attenuates Atherosclerosis by Reducing Endothelial Inflammation. Circ Res. 2022 Apr;130(7):1038-1055.
Guo J, Qiu J, Jia M, Li Q, Wei X, Li L, Pan Q, Jin J, Ge F, Ma S, He Y, Lin J, Li Y, Ma J, Jiang N, Zhi X, Jiang L, Zhang J, Osto E, Jing Q, Wang X, Meng D. BACH1 deficiency prevents neointima formation and maintains the differentiated phenotype of vascular smooth muscle cells by regulating chromatin accessibility. Nucleic Acids Res. 2023 May 22;51(9):4284-4301.





