
随着社会压力增大,尤其是近几年新冠病毒全球大流行,精神障碍患者逐渐增多,精神药物的使用率逐渐升高。据统计,近年来精神药物服用率升高了3.8倍,其中第二代抗精神病药的使用率更是升高了18.1倍。随着抗精神病药的大量使用,这类药物的心脏毒性逐渐凸显出来,并引起科学关注。据新英格兰医学杂志的一项研究结果显示,与不用药人群相比,长期服用第一代及第二代抗精神病药引起心源性猝死的概率分别升高1.99倍及2.26倍。然而,虽然已有大量临床研究报道了抗精神病药心肌损伤效应,抗精神病药心脏毒性的分子机制仍有待揭示。
2022年6月24日,复旦大学遗传工程国家重点实验室、复旦大学人类表型组研究院、复旦大学上海医学院金力院士与上海市心血管病研究所、复旦大学附属中山医院邹云增教授与复旦大学基础医学院李立亮副教授团队合作,在Nature旗下Signal Transduction and Targeted Therapy杂志上发表了题为“CB1R-stabilized NLRP3 inflammasome drives antipsychotics cardiotoxicity”的研究论文,鉴定了1型大麻素受体(CB1R)作为抗精神病药的心肌直接膜受体,介导了多种抗精神病药引起的心肌焦亡与毒性过程。并从转化医学角度,比较了多种CB1R选择性拮抗剂在小鼠模型中的治疗安全性,提出了安全、低毒的CB1R拮抗剂作为药物毒性的联合治疗策略。

研究人员首先以抗精神病药奥氮平、氯氮平为代表,采用与临床治疗匹配的剂量建立了与人类等效的血浆暴露后,发现随着抗精神病药给药时间延长,药物在心脏中出现了明显的蓄积。抗精神病药引起的心脏毒性比代谢毒性更早出现。进一步,研究人员采用转录组学技术发现慢性奥氮平暴露的小鼠心脏中,多个程序性细胞死亡通路,尤其是细胞焦亡被显著富集。依次采用多种焦亡通路抑制剂或基因敲除小鼠时,观察到抗精神病药引起的心肌损伤程度显著缓解。
李立亮团队前期开展了抗精神病药慢性暴露的小鼠心脏多组学研究(Pharmacological Research, 2021)。为了揭示外源性抗精神病药如何激活胞内细胞焦亡过程,研究人员结合前期多组学数据,开发了基于细胞焦亡的组学分析技术,发现了内源性大麻素系统在抗精神病药心脏毒性中的重要作用,并采用分子对接及表面等离子共振技术证实1型大麻素受体(CB1R)是多种抗精神病药的心肌直接膜受体。抗精神病药可与内源性大麻素竞争结合CB1R并促进CB1R转位至胞浆。胞浆定位的CB1R以第177-209氨基酸结构域直接与NLRP3炎性体结合,抑制了炎性体的降解过程,从而激活了心肌细胞焦亡过程(图1)。药物抑制或基因敲除CB1R后,抗精神病药心脏毒性显著改善。
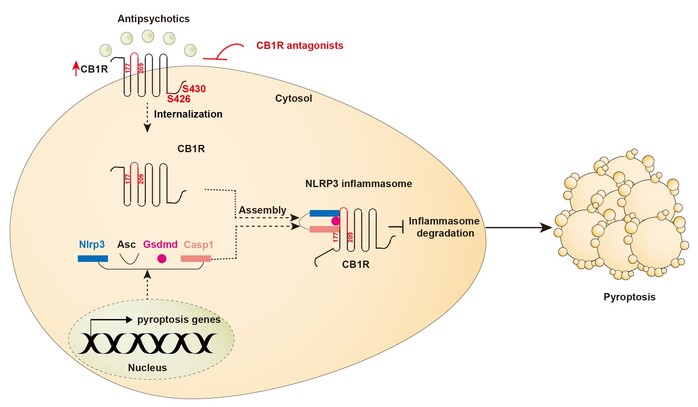
CB1R介导抗精神病药引起的心肌焦亡和损伤模式图
由于目前临床治疗药物约40%是基于G蛋白偶联受体(GPCR)开发的,CB1R作为GPCR的一种,其拮抗剂可能具有重要的临床转化潜能。为此,研究人员考察了多个CB1R拮抗剂的安全性,发现CB1R代表性拮抗剂Rimonabant具有新的毒副作用,而拮抗剂如AM 251、AM 281则不引起小鼠肝、肾、肺明显毒性,具有安全、低毒的效果。考虑到抗精神病药心脏毒性和代谢毒性是临床主要的毒副表现,而CB1R拮抗剂也具有改善代谢的功效,研究人员最后展望了新一代CB1R拮抗剂同时改善抗精神病药心脏毒性和代谢毒性的“一箭双雕”式双重功效。
复旦大学遗传工程国家重点实验室、复旦大学人类表型组研究院、复旦大学上海医学院金力院士、复旦大学附属中山医院、上海市心血管病研究所邹云增教授、复旦大学基础医学院法医学系李立亮副教授为本研究的共同通讯作者。复旦大学基础医学院法医学系李立亮及复旦大学附属中山医院高攀副研究员为本研究的共同第一作者。该研究得到北京生命科学研究所邵峰院士、上海科技大学刘志杰院士和华甜教授、复旦大学基础医学院张志刚教授提供的重要研究材料。研究受到国家自然科学基金面上项目、青年科学基金项目、上海市卫健委研究项目、复旦大学校内原创科研项目等资助。





