8月13日,人体解剖学与组织胚胎学系王海杰教授科研组与谭玉珍教授科研组在《Stem Cell Reviews and Reports》发表了“c-kit+VEGFR-2+mesenchymal stem cells differentiate into cardiovascular cells and repair infarcted myocardium after transplantation”,提出骨髓源性c-kit+VEGFR-2+MSCs具有向心血管细胞分化潜能,移植后能够显著修复梗死心肌。


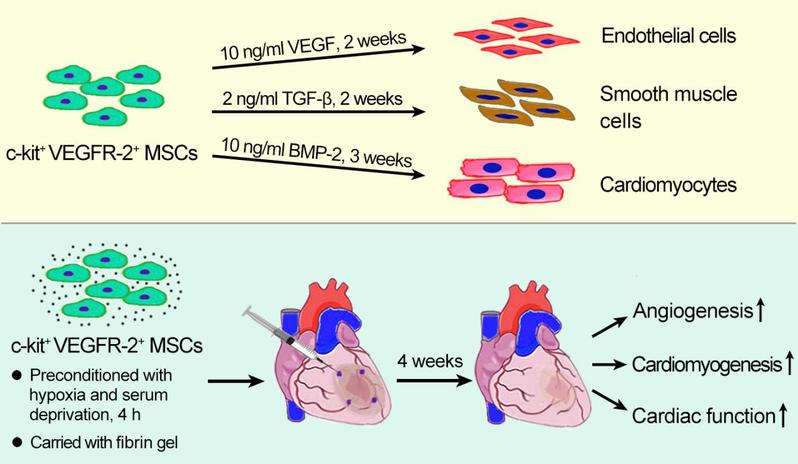
近年来,随着生活水平的不断改善,心血管疾病的发病率越来越高。心肌梗死是心血管疾病的主要死因之一,严重威胁着人们的生命和健康。心肌梗死后大量心肌细胞坏死,从而导致心肌纤维化和心功能降低,病人最终死于心力衰竭或心律失常。目前,干细胞移植在治疗心肌梗死方面具有前瞻性临床应用价值,然而选择理想的种子细胞对于提高干细胞移植治疗效率至关重要。作者继发现骨髓源性c-kit+间充质干细胞(Inter J Cardiol,2018)和CD34+VEGFR-3+淋巴管内皮祖细胞(Basic Res Cardiol,2019)后,通过密度梯度离心、流式分选和基因测序等技术从大鼠骨髓筛选出c-kit+VEGFR-2+间充质干细胞(c-kit+VEGFR-2+MSCs)。该群干细胞具有向心肌细胞、平滑肌细胞和内皮细胞分化的潜能,在心肌梗死模型移植后能够有效地促进心肌再生和血管新生,显著增强梗死心肌修复和心功能改善。与c-kit+VEGFR-2-MSCs比较,c-kit+VEGFR-2+MSCs有着较强的血管新生潜能和对缺血微环境的耐受力,故c-kit+VEGFR-2+ MSCs可作为干细胞移植治疗缺血性疾病的理想种子细胞。本文研究结果为临床开展干细胞移植治疗心肌梗死等缺血性疾病提供了新思路和可行性实验依据。
复旦大学周佩博士和于树娜博士为本文的共同第一作者,谭玉珍教授和王海杰教授为共同通讯作者。本研究得到国家自然科学基金(81470385、81770288、81870215)和高等学校博士学科点专项科研基金项目(20130071110080)资助。






